دوره 28، شماره 4 - ( پاییز 1401 )
جلد 28 شماره 4 صفحات 477-464 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Vakilpour M, Khazaei-Koohpar Z. First Report of Variable Number of Tandem Repeat Alleles in Phenylalanine Hydroxylase Gene in Patients With Phenylketonuria From Guilan Province, Iran. Intern Med Today 2022; 28 (4) :464-477
URL: http://imtj.gmu.ac.ir/article-1-3917-fa.html
URL: http://imtj.gmu.ac.ir/article-1-3917-fa.html
وکیل پور مریم، خزائی کوهپر زینب. اولین گزارش از تعداد تکرارهای پشت سر هم متغیر در ژن فنیل آلانین هیدروکسیلاز در بیماران فنیل کتونوری از استان گیلان، ایران. طب داخلی روز. 1401; 28 (4) :464-477
1- گروه ژنتیک، دانشکده علوم زیستی، واحد تنکابن، دانشگاه آزاد اسلامی، تنکابن، ایران.
2- گروه زیست شناسی سلولی و مولکولی، دانشکده علوم زیستی، واحد تنکابن، دانشگاه آزاد اسلامی، تنکابن، ایران. ،ze.khazaei@iau.ac.ir
2- گروه زیست شناسی سلولی و مولکولی، دانشکده علوم زیستی، واحد تنکابن، دانشگاه آزاد اسلامی، تنکابن، ایران. ،
متن کامل [PDF 4802 kb]
(934 دریافت)
| چکیده (HTML) (2698 مشاهده)
تعیین توالی
پس از مشاهده باند واضح قطعات تکثیرشده (محصولات PCR) بر روی ژل آگارز 2 درصد، برای اطمینان از حضور تکرارهای VNTR، محصولات PCR تعیین توالی شدند. تعیین توالی توسط دستگاه سکوئنسر ABI3730 (شرکت Macrogen کره جنوبی) صورت گرفت. همچنین از نرمافزار CLC main work bench v3.5 جهت خوانش توالیها و مقایسه دستگاه سکوئنسر استفاده شد. روش آماری مورد استفاده در مطالعه حاضر توصیفی میباشد که برای متغیر سن بیماران از شاخص میانگین و برای آللهای VNTR از توزیع فراوانی (درصد) استفاده شده است.
یافتهها
فنوتیپ بیماران
در این مطالعه از 25 بیمار، 9 نفر (36 درصد) در گروه فنیلکتونوری کلاسیک، 8 نفر (32 درصد) در گروه فنیلکتونوری خفیف و 8 نفر (32 درصد) در گروه هیپرفنیلآلانینمی خفیف طبقهبندی شدند. سطح فنیلآلانین سرمی قبل از درمان 25 بیمار 320 تا 2453 میکرومول بر لیتر تعیین شد. میزان ازدواج فامیلی در بین والدین بیماران 52 درصد بود. میانگین سن بیماران 8/4 سال ( محدوده 1-21 سال) بود و ترکیب قومیتی آنها شامل گیلک 19 (76 درصد)، تالش 3 (12 درصد) و ترک 3 (12 درصد) بود.
نتایج نانواسپکتروفتومتر
اسپکتروفتومتر بهترتیب کمیت DNA استخراجشده را در محدوده 500-100 نانوگرم بر میکرولیتر و نسبت جذب 260/280 را در محدوده 1/8-2 نشان داد که DNA استخراجشده با کمیت و خلوص مذکور برای انجام PCR مناسب بود.
نتیجه الکتروفورز محصولات PCR
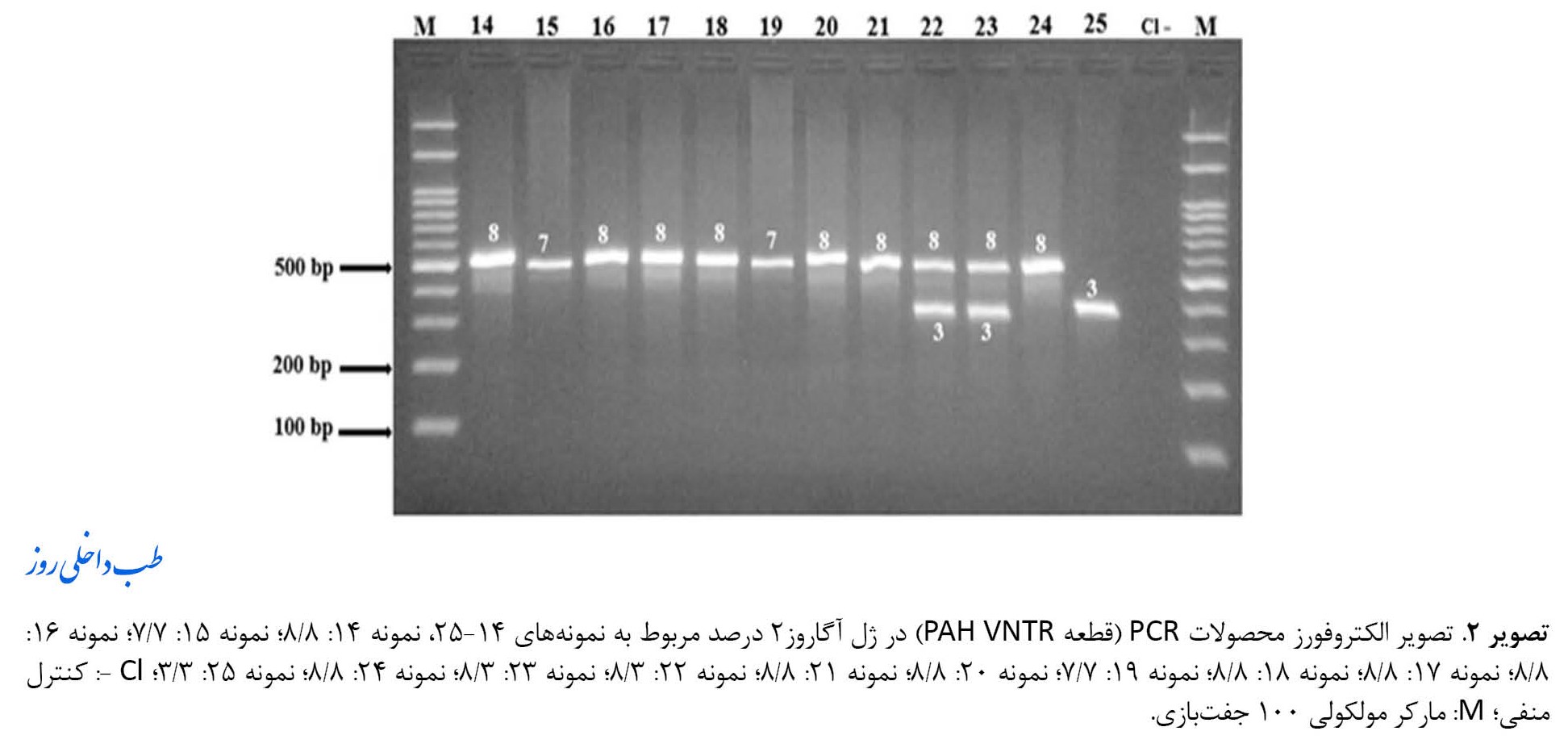
تصویر الکتروفورز محصولات PCR بر روی ژل آگارز 2 درصد و باندهای مربوط به قطعات PAH VNTR در تصاویر شماره 1 و 2 نشان داده شده است.
متن کامل: (1438 مشاهده)
مقدمه
فنیلکتونوری و هیپرفنیلآلانینمی حاصل نقص فنیلآلانین هیدروکسیلاز کبدی است که منجر به افزایش غیرطبیعی فنیلآلانین سرمی یعنی بیش از 120 میکرومول بر لیتر میشود که منجر به عقبماندگی غیرقابل برگشت ذهنی در بیماران درماننشده میشود [1]. فنیلکتونوری بیماری اتوزومال مغلوب و شایعترین اختلال متابولیسم اسیدآمینه با دامنه وسیعی از تظاهرات بالینی و بیوشیمیایی است که ازنظر جغرافیایی شیوع متفاوتی دارد [2]. شیوع فنیلکتونوری در سفیدپوستان، 1 در 10000 تولد است، اما بهطور قابل توجهی در منطقه مدیترانه شرقی بیشتر است. درواقع بیشترین شیوع فنیلکتونوری در این دو منطقه از جهان گزارش شده است، 1 در 4000 در ترکیه و 1 در 3627 در ایران. این شیوع بالا را میتوان در درجه اول ناشی از نرخ بالای ازدواج فامیلی در منطقه دانست [3].
در مطالعه دیگری بیشترین شیوع در ترکیه و کمترین شیوع در امارات گزارش شده است [4]. هیپرفنیلآلانینمی حاصل هر گونه افزایش سطح فنیلآلانین خون میباشد. این سطح در کودکان سالم کمتر از 120 میکرومول بر لیتر است [5]. در هیپرفنیلآلانینمی خفیف 120-600 میکرومول بر لیتر، در فنیلکتونوری خفیف 600-1200 میکرومول بر لیتر و در فنیلکتونوری کلاسیک بیش از 1200 میکرومول بر لیتر است [6]. ژن فنیلآلانین هیدروکسیلاز با طول 90 کیلوباز روی کروموزوم 12 در ناحیه q22-q24.1 واقع شده است که شامل 13 اگزون و 12 اینترون میباشد [7]. پروتئین فنیلآلانین هیدروکسیلاز کبدی ساختار تترامری با چندین زیر واحد دارد که هریک از 3 دامین، دامین تنظیمی در N ترمینال و 1 دامین کاتالیتیک و 1 دامین تترامریزه شدن در C ترمینال تشکیل میشوند [7].
عامل اصلی فنیلکتونوری محدوده وسیعی از موتاسیونها در ژن فنیلآلانین هیدروکسیلاز است [8]. در ژن فنیلآلانین هیدروکسیلاز حدود 1180 واریانت دو آللی شناسایی شده است [6]. بهعلاوه ژن فنیلآلانین هیدروکسیلاز دارای نشانگرهای چند شکلی مختلف مانند تکرارهای پشت سر هم کوتاه درون ژنی (STRs) واقع در اینترون 3، تعداد تکرارهای پشت سر هم متغیر درون ژنی واقع در ناحیه ترجمه نشدنی ʹ3 (3ʹ-UTR) و چندین پلی مورفیسم قطعات حاصل از عمل آنزیمهای محدودکننده (RFLPs) است که بهشدت با ناحیه فنیلآلانین هیدروکسیلاز مرتبط هستند [9]. پلی مورفیسم چند آللی VNTR یک واحد تکراری غنی از AT،30 جفتبازی دارد و چندین آلل این پلی مورفیسم در دنیا شناسایی و گزارش شده است [3]. نشانگرهای چند شکلی که بهشدت با ژن فنیلآلانین هیدروکسیلاز مرتبط هستند، تشخیص قبل از تولد و شناسایی ناقلین را تسهیل میکنند [10]. تاکنون مطالعات زیادی در مورد توالیهای تکراری پشت سر هم PAH VNTR انجام شده است. در این مطالعات پلی مورفیسم این توالی، ارتباط آن با انواع جهشهای ژن فنیلآلانین هیدروکسیلاز، توانایی این توالی در شناسایی ناقلین فنیلکتونوری و استفاده از توالی VNTR در کنار توالیهای تکراری STR در پزشکی قانونی نیز مورد توجه قرار گرفته است [10].
از جمله مطالعات انجامشده شامل مطالعه حسینی مزینانی و همکاران در سال 2008 بود که در آن 4 نوع آلل VNTR با 3، 7، 8 و 9 تکرار در کروموزومهای فنیلکتونوری شناسایی شد [3]. در مطالعه دیگری که در سال 2017 رضیپور و همکاران در بیماران فنیلکتونوری ایرانی انجام دادند 5 آلل VNTR با 3، 7، 8، 9 و 12 تکرار گزارش شد [9]. همچنین در مطالعه عابدینی و خزائی در سال 2020، 5 آلل VNTR با 3، 7، 8، 9 و 12 تکرار در بیماران فنیلکتونوری در شمال ایران شناسایی شد [10]. بهطورکلی سیستمهای چند شکلی درجه بالایی از ناهمگنی دارند و برای تشخیص قبل از تولد و غربالگری ناقلین در اکثر جمعیتها بسیار اطلاعرسان هستند [10]. براساس مطالعات انجامشده در ایران، آللهای VNTR در جمعیت ایران 66 درصد اطلاعرسان بوده است [3]. باتوجهبه شیوع بالای فنیلکتونوری و ازدواجهای فامیلی در جمعیت ایرانی مطالعه فعلی به منظور شناسایی آللهای PAH VNTR در بیماران فنیلکتونوری در استان گیلان انجام شد.
مواد و روشها
بیماران
این مطالعه از نوع توصیفیمقطعی میباشد. جامعه مورد بررسی در این مطالعه، 25 فرد مبتلا به بیماری فنیلکتونوری، غیر خویشاوند و از نواحی مختلف استان گیلان میباشند که جهت درمان به بیمارستان 17 شهریور رشت مراجعه کردهاند (طی یک دوره 1 ساله) و بیماری آنها توسط پزشک متخصص کودکان تأیید شده است. شناسایی این بیماران براساس پروندههای موجود در بیمارستان 17 شهریور رشت صورت گرفت. فقط 1 بیمار از هر خانواده وارد مطالعه شد. سطح فنیلآلانین قبل از درمان در 25 بیمار 320 تا 2453 میکرومول بر لیتر تعیین شد. سپس از بیماران و خانوادههای آنها جهت شرکت در این مطالعه دعوت به عمل آمد. پس از توجیه شرکتکنندگان، فرمهای رضایتنامه و پرسشنامه از سوی بیماران و یا خانوادههای آنان تکمیل شد (در مواردی که بیمار کودک یا دچار عقبماندگی ذهنی بود). نمونهگیری با مجوز کمیته اخلاق در پژوهش دانشگاه آزاد اسلامی واحد رشت انجام شد. به منظورجمعآوری نمونههای خون از هر فرد بیمار به میزان 2-5 میلیلیتر خونگیری به عمل آمد و برای جلوگیری از انعقاد خون، از فالکونهای 15 میلیلیتری حاوی 300 میکرولیتر EDTA 0/5 مولار بهعنوان ماده ضدانعقاد استفاده شد.
استخراج DNA
برای استخراج DNA از کیت DynabioTM، کیت استخراج دنا از خون و بافت (تکاپوزیست، تهران، ایران) استفاده شد که استخراج سریع، بازده و درجه خلوص بالا از ویژگیهای این کیت میباشد. پس از استخراج DNA و قبل از انجام واکنش PCR جهت بررسی کمیت و خلوص اسید نوکلئیک، DNA بهدستآمده با نانواسپکتروفتومتر (Thermo Scientific NanoDrop,2000C,USA) بررسی شد.
واکنش زنجیرهای پلیمراز
واکنش PCR در دستگاه ترموسایکلر ساخت کشور آلمان انجام شد. توالی پرایمرهای رفت و برگشت مورد استفاده در این واکنش بهصورت زیر بود [3]:
پرایمر رفت: 5′-GCTTGAAACTTGAAAGTTGC-3′
پرایمر برگشت: 5ʹ-GGAAACTTAAGAATCCCATC-3ʹ
سنتز پرایمرها توسط شرکت Bioneer، کرهجنوبی صورت گرفت. حجم نهایی مخلوط واکنش PCR، 25 میکرولیتر بود که با استفاده از کیت AccuPower® PCR PreMix (شرکت Bioneer، کرهجنوبی) و با افزودن DNA ژنومی، جفت پرایمر (pmol 20) و آب استریل به محلول PreMix تهیه شد. نتایج حاصل از تنظیم شرایط واکنش زنجیرهای پلیمراز جهت تکثیر قطعه PAH VNTR بهصورت زیر میباشد:
دمای واسرشتگی اولیه 94 درجه سانتیگراد بهمدت 10 دقیقه،
تعداد سیکلهای واکنش، 30 سیکل که هر سیکل شامل:
-دمای واسرشتگی 94 درجه سانتیگراد بهمدت 1 دقیقه؛
-دمای اتصال پرایمرها 65 درجه سانتیگراد بهمدت 1 دقیقه؛
-دمای طویلسازی 72 درجه سانتیگراد بهمدت 1 دقیقه؛
-دمای طویلسازی نهایی 72 درجه سانتیگراد بهمدت 5 دقیقه.
الکتروفورز محصولات PCR
برای اطمینان از تکثیر قطعه مورد نظر و کیفیت آن و عدم تکثیر محصولات غیراختصاصی، 3 میکرولیتر از محصولات واکنش (نمونههای بیماران) و مارکر bp 100 بر روی ژل آگارز 2 درصد بارگذاری و الکتروفورز شد (تصاویر شماره 1-الف و 1-ب).
فنیلکتونوری و هیپرفنیلآلانینمی حاصل نقص فنیلآلانین هیدروکسیلاز کبدی است که منجر به افزایش غیرطبیعی فنیلآلانین سرمی یعنی بیش از 120 میکرومول بر لیتر میشود که منجر به عقبماندگی غیرقابل برگشت ذهنی در بیماران درماننشده میشود [1]. فنیلکتونوری بیماری اتوزومال مغلوب و شایعترین اختلال متابولیسم اسیدآمینه با دامنه وسیعی از تظاهرات بالینی و بیوشیمیایی است که ازنظر جغرافیایی شیوع متفاوتی دارد [2]. شیوع فنیلکتونوری در سفیدپوستان، 1 در 10000 تولد است، اما بهطور قابل توجهی در منطقه مدیترانه شرقی بیشتر است. درواقع بیشترین شیوع فنیلکتونوری در این دو منطقه از جهان گزارش شده است، 1 در 4000 در ترکیه و 1 در 3627 در ایران. این شیوع بالا را میتوان در درجه اول ناشی از نرخ بالای ازدواج فامیلی در منطقه دانست [3].
در مطالعه دیگری بیشترین شیوع در ترکیه و کمترین شیوع در امارات گزارش شده است [4]. هیپرفنیلآلانینمی حاصل هر گونه افزایش سطح فنیلآلانین خون میباشد. این سطح در کودکان سالم کمتر از 120 میکرومول بر لیتر است [5]. در هیپرفنیلآلانینمی خفیف 120-600 میکرومول بر لیتر، در فنیلکتونوری خفیف 600-1200 میکرومول بر لیتر و در فنیلکتونوری کلاسیک بیش از 1200 میکرومول بر لیتر است [6]. ژن فنیلآلانین هیدروکسیلاز با طول 90 کیلوباز روی کروموزوم 12 در ناحیه q22-q24.1 واقع شده است که شامل 13 اگزون و 12 اینترون میباشد [7]. پروتئین فنیلآلانین هیدروکسیلاز کبدی ساختار تترامری با چندین زیر واحد دارد که هریک از 3 دامین، دامین تنظیمی در N ترمینال و 1 دامین کاتالیتیک و 1 دامین تترامریزه شدن در C ترمینال تشکیل میشوند [7].
عامل اصلی فنیلکتونوری محدوده وسیعی از موتاسیونها در ژن فنیلآلانین هیدروکسیلاز است [8]. در ژن فنیلآلانین هیدروکسیلاز حدود 1180 واریانت دو آللی شناسایی شده است [6]. بهعلاوه ژن فنیلآلانین هیدروکسیلاز دارای نشانگرهای چند شکلی مختلف مانند تکرارهای پشت سر هم کوتاه درون ژنی (STRs) واقع در اینترون 3، تعداد تکرارهای پشت سر هم متغیر درون ژنی واقع در ناحیه ترجمه نشدنی ʹ3 (3ʹ-UTR) و چندین پلی مورفیسم قطعات حاصل از عمل آنزیمهای محدودکننده (RFLPs) است که بهشدت با ناحیه فنیلآلانین هیدروکسیلاز مرتبط هستند [9]. پلی مورفیسم چند آللی VNTR یک واحد تکراری غنی از AT،30 جفتبازی دارد و چندین آلل این پلی مورفیسم در دنیا شناسایی و گزارش شده است [3]. نشانگرهای چند شکلی که بهشدت با ژن فنیلآلانین هیدروکسیلاز مرتبط هستند، تشخیص قبل از تولد و شناسایی ناقلین را تسهیل میکنند [10]. تاکنون مطالعات زیادی در مورد توالیهای تکراری پشت سر هم PAH VNTR انجام شده است. در این مطالعات پلی مورفیسم این توالی، ارتباط آن با انواع جهشهای ژن فنیلآلانین هیدروکسیلاز، توانایی این توالی در شناسایی ناقلین فنیلکتونوری و استفاده از توالی VNTR در کنار توالیهای تکراری STR در پزشکی قانونی نیز مورد توجه قرار گرفته است [10].
از جمله مطالعات انجامشده شامل مطالعه حسینی مزینانی و همکاران در سال 2008 بود که در آن 4 نوع آلل VNTR با 3، 7، 8 و 9 تکرار در کروموزومهای فنیلکتونوری شناسایی شد [3]. در مطالعه دیگری که در سال 2017 رضیپور و همکاران در بیماران فنیلکتونوری ایرانی انجام دادند 5 آلل VNTR با 3، 7، 8، 9 و 12 تکرار گزارش شد [9]. همچنین در مطالعه عابدینی و خزائی در سال 2020، 5 آلل VNTR با 3، 7، 8، 9 و 12 تکرار در بیماران فنیلکتونوری در شمال ایران شناسایی شد [10]. بهطورکلی سیستمهای چند شکلی درجه بالایی از ناهمگنی دارند و برای تشخیص قبل از تولد و غربالگری ناقلین در اکثر جمعیتها بسیار اطلاعرسان هستند [10]. براساس مطالعات انجامشده در ایران، آللهای VNTR در جمعیت ایران 66 درصد اطلاعرسان بوده است [3]. باتوجهبه شیوع بالای فنیلکتونوری و ازدواجهای فامیلی در جمعیت ایرانی مطالعه فعلی به منظور شناسایی آللهای PAH VNTR در بیماران فنیلکتونوری در استان گیلان انجام شد.
مواد و روشها
بیماران
این مطالعه از نوع توصیفیمقطعی میباشد. جامعه مورد بررسی در این مطالعه، 25 فرد مبتلا به بیماری فنیلکتونوری، غیر خویشاوند و از نواحی مختلف استان گیلان میباشند که جهت درمان به بیمارستان 17 شهریور رشت مراجعه کردهاند (طی یک دوره 1 ساله) و بیماری آنها توسط پزشک متخصص کودکان تأیید شده است. شناسایی این بیماران براساس پروندههای موجود در بیمارستان 17 شهریور رشت صورت گرفت. فقط 1 بیمار از هر خانواده وارد مطالعه شد. سطح فنیلآلانین قبل از درمان در 25 بیمار 320 تا 2453 میکرومول بر لیتر تعیین شد. سپس از بیماران و خانوادههای آنها جهت شرکت در این مطالعه دعوت به عمل آمد. پس از توجیه شرکتکنندگان، فرمهای رضایتنامه و پرسشنامه از سوی بیماران و یا خانوادههای آنان تکمیل شد (در مواردی که بیمار کودک یا دچار عقبماندگی ذهنی بود). نمونهگیری با مجوز کمیته اخلاق در پژوهش دانشگاه آزاد اسلامی واحد رشت انجام شد. به منظورجمعآوری نمونههای خون از هر فرد بیمار به میزان 2-5 میلیلیتر خونگیری به عمل آمد و برای جلوگیری از انعقاد خون، از فالکونهای 15 میلیلیتری حاوی 300 میکرولیتر EDTA 0/5 مولار بهعنوان ماده ضدانعقاد استفاده شد.
استخراج DNA
برای استخراج DNA از کیت DynabioTM، کیت استخراج دنا از خون و بافت (تکاپوزیست، تهران، ایران) استفاده شد که استخراج سریع، بازده و درجه خلوص بالا از ویژگیهای این کیت میباشد. پس از استخراج DNA و قبل از انجام واکنش PCR جهت بررسی کمیت و خلوص اسید نوکلئیک، DNA بهدستآمده با نانواسپکتروفتومتر (Thermo Scientific NanoDrop,2000C,USA) بررسی شد.
واکنش زنجیرهای پلیمراز
واکنش PCR در دستگاه ترموسایکلر ساخت کشور آلمان انجام شد. توالی پرایمرهای رفت و برگشت مورد استفاده در این واکنش بهصورت زیر بود [3]:
پرایمر رفت: 5′-GCTTGAAACTTGAAAGTTGC-3′
پرایمر برگشت: 5ʹ-GGAAACTTAAGAATCCCATC-3ʹ
سنتز پرایمرها توسط شرکت Bioneer، کرهجنوبی صورت گرفت. حجم نهایی مخلوط واکنش PCR، 25 میکرولیتر بود که با استفاده از کیت AccuPower® PCR PreMix (شرکت Bioneer، کرهجنوبی) و با افزودن DNA ژنومی، جفت پرایمر (pmol 20) و آب استریل به محلول PreMix تهیه شد. نتایج حاصل از تنظیم شرایط واکنش زنجیرهای پلیمراز جهت تکثیر قطعه PAH VNTR بهصورت زیر میباشد:
دمای واسرشتگی اولیه 94 درجه سانتیگراد بهمدت 10 دقیقه،
تعداد سیکلهای واکنش، 30 سیکل که هر سیکل شامل:
-دمای واسرشتگی 94 درجه سانتیگراد بهمدت 1 دقیقه؛
-دمای اتصال پرایمرها 65 درجه سانتیگراد بهمدت 1 دقیقه؛
-دمای طویلسازی 72 درجه سانتیگراد بهمدت 1 دقیقه؛
-دمای طویلسازی نهایی 72 درجه سانتیگراد بهمدت 5 دقیقه.
الکتروفورز محصولات PCR
برای اطمینان از تکثیر قطعه مورد نظر و کیفیت آن و عدم تکثیر محصولات غیراختصاصی، 3 میکرولیتر از محصولات واکنش (نمونههای بیماران) و مارکر bp 100 بر روی ژل آگارز 2 درصد بارگذاری و الکتروفورز شد (تصاویر شماره 1-الف و 1-ب).
تعیین توالی
پس از مشاهده باند واضح قطعات تکثیرشده (محصولات PCR) بر روی ژل آگارز 2 درصد، برای اطمینان از حضور تکرارهای VNTR، محصولات PCR تعیین توالی شدند. تعیین توالی توسط دستگاه سکوئنسر ABI3730 (شرکت Macrogen کره جنوبی) صورت گرفت. همچنین از نرمافزار CLC main work bench v3.5 جهت خوانش توالیها و مقایسه دستگاه سکوئنسر استفاده شد. روش آماری مورد استفاده در مطالعه حاضر توصیفی میباشد که برای متغیر سن بیماران از شاخص میانگین و برای آللهای VNTR از توزیع فراوانی (درصد) استفاده شده است.
یافتهها
فنوتیپ بیماران
در این مطالعه از 25 بیمار، 9 نفر (36 درصد) در گروه فنیلکتونوری کلاسیک، 8 نفر (32 درصد) در گروه فنیلکتونوری خفیف و 8 نفر (32 درصد) در گروه هیپرفنیلآلانینمی خفیف طبقهبندی شدند. سطح فنیلآلانین سرمی قبل از درمان 25 بیمار 320 تا 2453 میکرومول بر لیتر تعیین شد. میزان ازدواج فامیلی در بین والدین بیماران 52 درصد بود. میانگین سن بیماران 8/4 سال ( محدوده 1-21 سال) بود و ترکیب قومیتی آنها شامل گیلک 19 (76 درصد)، تالش 3 (12 درصد) و ترک 3 (12 درصد) بود.
نتایج نانواسپکتروفتومتر
اسپکتروفتومتر بهترتیب کمیت DNA استخراجشده را در محدوده 500-100 نانوگرم بر میکرولیتر و نسبت جذب 260/280 را در محدوده 1/8-2 نشان داد که DNA استخراجشده با کمیت و خلوص مذکور برای انجام PCR مناسب بود.
نتیجه الکتروفورز محصولات PCR
تصویر الکتروفورز محصولات PCR بر روی ژل آگارز 2 درصد و باندهای مربوط به قطعات PAH VNTR در تصاویر شماره 1 و 2 نشان داده شده است.
محصولاتPCR مربوط به آللهای PAH VNTR، قطعات 380، 500 و530 جفتبازی را تولید کردند که آنها بهترتیب با حضور آللهای 3، 7 و 8 تکرار مطابقت داشتند. از میان 50 آلل مورد بررسی، آللهای مربوط به تکرارهای 3، 7 و 8 بهترتیب دارای فراوانی 6 (12 درصد)، 6 (12 درصد) و 33 (66 درصد) بودند. همچنین 5 آلل (10 درصد) بهصورت نامشخصبود. جدول شماره 1 تعداد و فراوانی نسبی آللهای PAH VNTR مربوط به بیماران مورد مطالعه را نشان میدهد.

همچنین ژنوتیپهای مشاهدهشده در افراد مورد بررسی در جدول شماره 2 ارائه شده است.

نتایج تعیین توالی
پس از واکنش PCR، برای تأیید تعداد تکرارهای VNTR، محصولات PCR تعیین توالی شدند. توالی بازی آللهای PAH VNTR با نرمافزار CLC main work bench v 3.5 تعیین شد. به این ترتیب تعداد تکرارهای VNTRمشخص شد (جدول شماره 1). برای مثال، تعیین توالی محصول PCR مربوط به بیمار شماره 11 تأیید کرد که آلل VNTR این بیمار دارای 7 تکرار با طول 30 نوکلئوتید میباشد:
1- TGCACATATATGTATATGCATATGTACGTA
2- TGCACATATATGTATATGCATATGTACGTA
3- TGCACATATATGTATATGCATATGTACGTA
4- TGCACATATATGTATATGCATATGTACGTA
5- TGCACATATATGTATATGCATATGTACGTA
6- TGCACATATATGTATGTGCATATGTACGTA
7- TGCACATATATGTATGTGCATATGTATGTA
بحث
آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز قبلاً توسط آیزنسمیت و همکاران شرح داده شد [11] در این مطالعه، آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز، در 25 بیمار فنیلکتونوری در استان گیلان برای اولین بار مورد بررسی قرارگرفت و 3 آلل VNTR با تکرارهای 3 ، 7 و 8 بهترتیب با فراوانی 12، 12 و 66 درصد شناسایی شد که بالاترین فراوانی مربوط به VNTR8 بود. قابل توجه است که VNTR8 در هر 3 گروه قومی گیلک، تالش و ترک مشاهده شد و بالاترین فراوانی مربوط به گروه قومی گیلک بود. مطالعات متعددی در مورد آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز در خانوادههای فنیلکتونوری ایرانی انجام شده است. در مطالعه ولیان و ابراهیمی آللهای مارکر PAH VNTR، با 3، 7، 8 و 9 تکرار در بیماران فنیلکتونوری در اصفهان گزارش شد [12]. در مطالعه حسینی مزینانی و همکاران 5 آلل VNTR با تکرارهای 3، 6، 7، 8 و 9 تایی در خانوادههای فنیلکتونوری ایرانی شناسایی شد، بهطوریکه توزیع آللها در کروموزومهای فنیلکتونوری بدین شرح بود: VNTR3 (7/1 درصد)، VNTR (صفر درصد)، VNTR7 (31/3 درصد)، VNTR8 (48/3 درصد) و VNTR9 (13/3 درصد). در این مطالعه بالاترین فراوانی متعلق به VNTR8 بود [3]. در مطالعه پریور و همکاران در استان یزد، 4 آلل VNTR دارای 3، 7، 8 و 12 تکرار بهترتیب با فراوانی 5/5، 11، 78 و 5/5 درصد در کروموزومهای فنیلکتونوری مشاهده شد. در مطالعه آنها نیز بیشترین فراوانی مربوط به آلل VNTR8 بود [13]. در مطالعه باقری و همکاران در استان آذربایجانغربی در 20 بیمار فنیلکتونوری، آللهای VNTR8 (95 درصد) و VNTR3 (5 درصد) گزارش شد [1]. در توافق با موارد فوق، در مطالعه حاضر نیز بالاترین فراوانی مربوط به VNTR8 بود. در مطالعه دیگری که توسط باقری و همکاران در بیماران ترکی-آذری ایرانی مبتلا به فنیلکتونوری انجام شد، 5 آلل VNTR شامل آللهای VNTR3 (15/1 درصد)، VNTR7 (3/49 درصد)، VNTR8 (74/4 درصد)، VNTR9 (5/81 درصد) و VNTR11 (1/16 درصد) شناسایی شد که در آن آلل با 8 تکرار بیشترین فراوانی را داشت [14]. بهعلاوه در مطالعه رضیپور و همکاران موتاسیونها و مینی هاپلوتایپ مرتبط با ژن فنیلآلانین هیدروکسیلاز در 81 بیمارفنیلکتونوری ایرانی مورد بررسی قرار گرفت که در مطالعه آنها، آللهای VNTR3، VNTR7، VNTR8، VNTR9 و VNTR12 مشاهده شد [9]. متعاقباً در مطالعه علی بخشی و همکاران 18 بیمار فنیلکتونوری غیر خویشاوند از 3 استان کرمانشاه، همدان و لرستان ازنظر موتاسیونها و ارتباط آنها با آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز مورد بررسی قرار گرفتند. مطالعه آنها منجر به شناسایی 11 موتاسیون اختصاصی و 4 آلل VNTR3، VNTR7، VNTR8 و VNTR9 شد [15].
در مطالعه دیگری که علی بخشی و همکاران در بیماران فنیلکتونوری با قومیت کرد در استان کرمانشاه انجام دادند نیز آللهای VNTR با 3، 7، 8 و 9 تکرار شناسایی شد که بیشترین فراوانی متعلق به آلل 8 تکرار بود [16]. درنهایت مطالعهای که در سال 2020 عابدینی و خزائی برای اولین بار در بیماران فنیلکتونوری از استان گلستان در شمال ایران انجام دادند، 26 بیمار فنیلکتونوری غیر خویشاوند ازنظر آللهای PAH VNTR مورد بررسی قرار گرفتند که منجر به شناسایی 5 آللVNTR3 :VNTR (28/85 درصد)، VNTR7 (28/58 درصد)، VNTR8 (17/3 درصد)، VNTR9 (19/23 درصد) و VNTR12 (5/77 درصد) شد. در مطالعه آنها برخلاف سایر مطالعات انجامشده در جمعیت فنیلکتونوری در مناطق مختلف ایران دو آلل VNTR3 و VNTR7 بیشترین فراوانی را دارا بودند [10]، درحالیکه در مطالعه حاضر از استان گیلان (یکی دیگر از استانهای واقع در شمال ایران) بیشترین فراوانی به VNTR8 اختصاص داشت. این تاحدی با طیف موتاسیونی مختلف در این جمعیتها میتواند مرتبط باشد. مثلاً جهش IVS10-11G>A شایعترین جهش عامل فنیلکتونوری در استان گلستان [17, 18] با VNTR7 مرتبط است (دادهها منتشرنشده)، درحالیکه جهش فوق در بیماران فنیلکتونوری از استان گیلان فراوانی کمی را نشان داده است [2].
بهعلاوه براساس مطالعات انجامشده، مشخص شده است فراوانی VNTR چندآللی در ژن فنیلآلانین هیدروکسیلاز بهطور معناداری در میان گروههای قومیتی متفاوت است. بنابراین ترکیب قومیتی متفاوت در این دو استان شمالی کشور میتواند دلیل دیگر تفاوت در فراوانی آللهای VNTR در این دو جمعیت باشد. از سوی دیگر فراوانی آلل VNTR3 در کروموزومهای فنیلکتونوری در استان گیلان تفاوت معناداری با گزارشات حاصله از جمعیت اروپایی داشت، بهطوریکه VNTR3 فراوانی کمتر و VNTR8 فراوانی بیشتری را نسبت به جمعیت اروپایی نشان میدهد [11] و این نیز تا حدی با طیفهای موتاسیونی مختلف در این جمعیتها مرتبط است. موتاسیون R408W شایعترین موتاسیون عامل فنیلکتونوری در جمعیتهای اروپایی است که با آلل VNTR3 بهویژه در نواحی شرقی این قاره مرتبط است [3، 19]. این موتاسیون در جمعیت ایرانی بسیار نادر است. باتوجهبه مطالعات انجامشده در ایران دررابطهبا آللهای PAH VNTR، در مطالعه حاضر در استان گیلان آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز تنوع کمی دارند. واضح است که نشانگرهایی با تعداد آلل بیشتر، میزان اطلاعرسانی بالاتری دارند. این مطالعه اولین گزارش از ساختار ژنتیک جمعیت فنیل کتونوری با استفاده از آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز در استان گیلان است. محدودیتهای تحقیق حاضر شامل حجم کم نمونه و عدم وجود بودجه کافی جهت بررسی نشانگر پلیمورفیک دیگر به نام STR مرتبط با ژن فنیلآلانین هیدروکسیلاز در بیماران فنیلکتونوری بود.
نتیجهگیری
باتوجهبه تنوع جمعیتی در ایران، نوع آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز ممکن است در مناطق مختلف متفاوت باشد. بنابراین بررسی فراوانی و پراکندگی آللهای نشانگر VNTR در مناطق مختلف کشور ضروری است، بهطورکلی این مطالعه یک کار مقدماتی برای استفاده عملی آینده از این توالی (VNTR) برای اهداف مختلف ازجمله شناسایی افراد هتروزیگوت در مورد فنیل کتونوری در جامعه و تجزیهوتحلیل جریان ژن در جمعیت بود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این تحقیق در دانشگاه آزاد اسلامی رشت با کد (REC.1397.138 IR.IAU.RASHT) تأیید شده است.
حامی مالی
این مقاله پژوهشی برگرفته از پایاننامه کارشناسی ارشد مریم وکیلپور،گروه ژنتیک، دانشکده علوم زیستی، واحد تنکابن، دانشگاه آزاد اسلامی تنکابن است (کد: 15930553962008). این تحقیق هیچگونه کمک مالی از سازمان های تأمین مالی در بخشهای عمومی، تجاری یا غیر انتفاعی دریافت نکرد.
مشارکت نویسندگان
نگارش و ویرایش متن: زینب خزائی کوهپر، جمعآوری دادهها و تحلیل آماری: مریم وکیلپور.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان مقاله از آقای دکتر افشین صفائی و پرسنل محترم بیمارستان 17 شهریور رشت که دست اندر کاران این پژوهش را یاری کردند، تشکر و قدردانی میکنند.

همچنین ژنوتیپهای مشاهدهشده در افراد مورد بررسی در جدول شماره 2 ارائه شده است.

نتایج تعیین توالی
پس از واکنش PCR، برای تأیید تعداد تکرارهای VNTR، محصولات PCR تعیین توالی شدند. توالی بازی آللهای PAH VNTR با نرمافزار CLC main work bench v 3.5 تعیین شد. به این ترتیب تعداد تکرارهای VNTRمشخص شد (جدول شماره 1). برای مثال، تعیین توالی محصول PCR مربوط به بیمار شماره 11 تأیید کرد که آلل VNTR این بیمار دارای 7 تکرار با طول 30 نوکلئوتید میباشد:
1- TGCACATATATGTATATGCATATGTACGTA
2- TGCACATATATGTATATGCATATGTACGTA
3- TGCACATATATGTATATGCATATGTACGTA
4- TGCACATATATGTATATGCATATGTACGTA
5- TGCACATATATGTATATGCATATGTACGTA
6- TGCACATATATGTATGTGCATATGTACGTA
7- TGCACATATATGTATGTGCATATGTATGTA
بحث
آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز قبلاً توسط آیزنسمیت و همکاران شرح داده شد [11] در این مطالعه، آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز، در 25 بیمار فنیلکتونوری در استان گیلان برای اولین بار مورد بررسی قرارگرفت و 3 آلل VNTR با تکرارهای 3 ، 7 و 8 بهترتیب با فراوانی 12، 12 و 66 درصد شناسایی شد که بالاترین فراوانی مربوط به VNTR8 بود. قابل توجه است که VNTR8 در هر 3 گروه قومی گیلک، تالش و ترک مشاهده شد و بالاترین فراوانی مربوط به گروه قومی گیلک بود. مطالعات متعددی در مورد آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز در خانوادههای فنیلکتونوری ایرانی انجام شده است. در مطالعه ولیان و ابراهیمی آللهای مارکر PAH VNTR، با 3، 7، 8 و 9 تکرار در بیماران فنیلکتونوری در اصفهان گزارش شد [12]. در مطالعه حسینی مزینانی و همکاران 5 آلل VNTR با تکرارهای 3، 6، 7، 8 و 9 تایی در خانوادههای فنیلکتونوری ایرانی شناسایی شد، بهطوریکه توزیع آللها در کروموزومهای فنیلکتونوری بدین شرح بود: VNTR3 (7/1 درصد)، VNTR (صفر درصد)، VNTR7 (31/3 درصد)، VNTR8 (48/3 درصد) و VNTR9 (13/3 درصد). در این مطالعه بالاترین فراوانی متعلق به VNTR8 بود [3]. در مطالعه پریور و همکاران در استان یزد، 4 آلل VNTR دارای 3، 7، 8 و 12 تکرار بهترتیب با فراوانی 5/5، 11، 78 و 5/5 درصد در کروموزومهای فنیلکتونوری مشاهده شد. در مطالعه آنها نیز بیشترین فراوانی مربوط به آلل VNTR8 بود [13]. در مطالعه باقری و همکاران در استان آذربایجانغربی در 20 بیمار فنیلکتونوری، آللهای VNTR8 (95 درصد) و VNTR3 (5 درصد) گزارش شد [1]. در توافق با موارد فوق، در مطالعه حاضر نیز بالاترین فراوانی مربوط به VNTR8 بود. در مطالعه دیگری که توسط باقری و همکاران در بیماران ترکی-آذری ایرانی مبتلا به فنیلکتونوری انجام شد، 5 آلل VNTR شامل آللهای VNTR3 (15/1 درصد)، VNTR7 (3/49 درصد)، VNTR8 (74/4 درصد)، VNTR9 (5/81 درصد) و VNTR11 (1/16 درصد) شناسایی شد که در آن آلل با 8 تکرار بیشترین فراوانی را داشت [14]. بهعلاوه در مطالعه رضیپور و همکاران موتاسیونها و مینی هاپلوتایپ مرتبط با ژن فنیلآلانین هیدروکسیلاز در 81 بیمارفنیلکتونوری ایرانی مورد بررسی قرار گرفت که در مطالعه آنها، آللهای VNTR3، VNTR7، VNTR8، VNTR9 و VNTR12 مشاهده شد [9]. متعاقباً در مطالعه علی بخشی و همکاران 18 بیمار فنیلکتونوری غیر خویشاوند از 3 استان کرمانشاه، همدان و لرستان ازنظر موتاسیونها و ارتباط آنها با آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز مورد بررسی قرار گرفتند. مطالعه آنها منجر به شناسایی 11 موتاسیون اختصاصی و 4 آلل VNTR3، VNTR7، VNTR8 و VNTR9 شد [15].
در مطالعه دیگری که علی بخشی و همکاران در بیماران فنیلکتونوری با قومیت کرد در استان کرمانشاه انجام دادند نیز آللهای VNTR با 3، 7، 8 و 9 تکرار شناسایی شد که بیشترین فراوانی متعلق به آلل 8 تکرار بود [16]. درنهایت مطالعهای که در سال 2020 عابدینی و خزائی برای اولین بار در بیماران فنیلکتونوری از استان گلستان در شمال ایران انجام دادند، 26 بیمار فنیلکتونوری غیر خویشاوند ازنظر آللهای PAH VNTR مورد بررسی قرار گرفتند که منجر به شناسایی 5 آللVNTR3 :VNTR (28/85 درصد)، VNTR7 (28/58 درصد)، VNTR8 (17/3 درصد)، VNTR9 (19/23 درصد) و VNTR12 (5/77 درصد) شد. در مطالعه آنها برخلاف سایر مطالعات انجامشده در جمعیت فنیلکتونوری در مناطق مختلف ایران دو آلل VNTR3 و VNTR7 بیشترین فراوانی را دارا بودند [10]، درحالیکه در مطالعه حاضر از استان گیلان (یکی دیگر از استانهای واقع در شمال ایران) بیشترین فراوانی به VNTR8 اختصاص داشت. این تاحدی با طیف موتاسیونی مختلف در این جمعیتها میتواند مرتبط باشد. مثلاً جهش IVS10-11G>A شایعترین جهش عامل فنیلکتونوری در استان گلستان [17, 18] با VNTR7 مرتبط است (دادهها منتشرنشده)، درحالیکه جهش فوق در بیماران فنیلکتونوری از استان گیلان فراوانی کمی را نشان داده است [2].
بهعلاوه براساس مطالعات انجامشده، مشخص شده است فراوانی VNTR چندآللی در ژن فنیلآلانین هیدروکسیلاز بهطور معناداری در میان گروههای قومیتی متفاوت است. بنابراین ترکیب قومیتی متفاوت در این دو استان شمالی کشور میتواند دلیل دیگر تفاوت در فراوانی آللهای VNTR در این دو جمعیت باشد. از سوی دیگر فراوانی آلل VNTR3 در کروموزومهای فنیلکتونوری در استان گیلان تفاوت معناداری با گزارشات حاصله از جمعیت اروپایی داشت، بهطوریکه VNTR3 فراوانی کمتر و VNTR8 فراوانی بیشتری را نسبت به جمعیت اروپایی نشان میدهد [11] و این نیز تا حدی با طیفهای موتاسیونی مختلف در این جمعیتها مرتبط است. موتاسیون R408W شایعترین موتاسیون عامل فنیلکتونوری در جمعیتهای اروپایی است که با آلل VNTR3 بهویژه در نواحی شرقی این قاره مرتبط است [3، 19]. این موتاسیون در جمعیت ایرانی بسیار نادر است. باتوجهبه مطالعات انجامشده در ایران دررابطهبا آللهای PAH VNTR، در مطالعه حاضر در استان گیلان آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز تنوع کمی دارند. واضح است که نشانگرهایی با تعداد آلل بیشتر، میزان اطلاعرسانی بالاتری دارند. این مطالعه اولین گزارش از ساختار ژنتیک جمعیت فنیل کتونوری با استفاده از آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز در استان گیلان است. محدودیتهای تحقیق حاضر شامل حجم کم نمونه و عدم وجود بودجه کافی جهت بررسی نشانگر پلیمورفیک دیگر به نام STR مرتبط با ژن فنیلآلانین هیدروکسیلاز در بیماران فنیلکتونوری بود.
نتیجهگیری
باتوجهبه تنوع جمعیتی در ایران، نوع آللهای VNTR در ژن فنیلآلانین هیدروکسیلاز ممکن است در مناطق مختلف متفاوت باشد. بنابراین بررسی فراوانی و پراکندگی آللهای نشانگر VNTR در مناطق مختلف کشور ضروری است، بهطورکلی این مطالعه یک کار مقدماتی برای استفاده عملی آینده از این توالی (VNTR) برای اهداف مختلف ازجمله شناسایی افراد هتروزیگوت در مورد فنیل کتونوری در جامعه و تجزیهوتحلیل جریان ژن در جمعیت بود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این تحقیق در دانشگاه آزاد اسلامی رشت با کد (REC.1397.138 IR.IAU.RASHT) تأیید شده است.
حامی مالی
این مقاله پژوهشی برگرفته از پایاننامه کارشناسی ارشد مریم وکیلپور،گروه ژنتیک، دانشکده علوم زیستی، واحد تنکابن، دانشگاه آزاد اسلامی تنکابن است (کد: 15930553962008). این تحقیق هیچگونه کمک مالی از سازمان های تأمین مالی در بخشهای عمومی، تجاری یا غیر انتفاعی دریافت نکرد.
مشارکت نویسندگان
نگارش و ویرایش متن: زینب خزائی کوهپر، جمعآوری دادهها و تحلیل آماری: مریم وکیلپور.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان مقاله از آقای دکتر افشین صفائی و پرسنل محترم بیمارستان 17 شهریور رشت که دست اندر کاران این پژوهش را یاری کردند، تشکر و قدردانی میکنند.
References
1.Bagheri M, Abdi Rad I, Hosseini Jazani N, Zarrin R, Ghazavi A. Association Between PAH Mutations and VNTR Alleles in the West Azerbaijani PKU Patients . MAEDICA: A Journal of Clinical Medicine. 2014; 9(3):242-7. [Link]
2.Nemati H, Karimi Yousefi SS, Pourvatan N, Aparviz R, Farzaneh P, Khazaei Koohpar Z, et al. Mutation analysis of phenylketonuria in the north of Iran. Gene Reports. 2021; 24:101196. [DOI:10.1016/j.genrep.2021.101196]
3.Hosseini-Mazinani SM, Koochmeshgi J, Khazaee-Koohpar Z, HoseinPur-Nobari N, Seifati SM. Carrier detection of phenylketonuria in Iranian families by variable number tandem-repeat polymorphism analysis. EMHJ-Eastern Mediterranean Health Journal. 2008; 14(6):1445-51. [Link]
4.Jafarzadeh-Esfehani R, Vojdani S, Hashemian S, Mirinezhad M, Pourafshar M, Forouzanfar N, et al. Genetic variants of the phenylalanine hydroxylase gene in patients with phenylketonuria in the northeast of Iran. Journal of Pediatric Endocrinology & Metabolism. 2020; 33(3):355-9. [DOI:10.1515/jpem-2019-0351] [PMID]
5.Gundorova P, Zinchenko RA, Makaov AK, Polyakov AV. The spectrum of mutations in the PAH gene in patients with hyperphenylalaninemia from the Karachay-Cherkess Republic. Russian Journal of Genetics. 2017; 53(7):813-9. [Link]
6.Hillert A, Anikster Y, Belanger-Quintana A, Burlina A, Burton BK, Carducci C, et al. The genetic landscape and epidemiology of Phenylketonuria. American Journal of Human Genetics. 2020; 107(2):234-250. [DOI:10.1016/j.ajhg.2020.06.006] [PMID] [PMCID]
7.Zarinkoob M, Khazaei Koohpar Z. Mutation analysis of exon 5 of PAH gene in phenylketonuria patients from Golestan Province, Iran. Journal of Shahrekord University of Medical Sciences. 2022; 24(1):15-9. [DOI:10.34172/jsums.2022.03]
8.Rastegar Moghadam M, Shojaei A, Babaei V, Rohani F, Ghazi F. Mutation analysis of Phenylalanine hydroxylase gene in Iranian patients with Phenylketonuria. Medical Journal of The Islamic Republic of Iran. 2018; 32:21. [DOI:10.14196/mjiri.32.21] [PMID] [PMCID]
9.Razipour M, Alavinejad E, Sajedi SZ, Talebi S, Entezam M, Mohajer N, et al. Genetic study of the PAH locus in the Iranian population: Familial gene mutations and minihaplotypes. Metabolic Brain Disease. 2017; 32(5):1685-91. [DOI:10.1007/s11011-017-0048-7] [PMID]
10.Abedini G, Khazaei Koohpar Z. Identifying variable number of tandem repeat alleles in phenylalanine hydroxylase gene in patients with phenylketonuria in Golestan Province, Iran. Journal of Advances in Medical and Biomedical Research. 2020; 28(129):198-203. [Link]
11.Eisensmith RC, Goltsov AA, Woo SL.A simple, rapid, and highly informative PCR-based procedure for prenatal diagnosis and carrier screening of phenylketonuria. Prenatal Diagnosis. 1994; 14 (12):1113-8. [DOI:10.1002/pd.1970141204]] [PMID]
12.Valian Borojeni S, Ebrahimi E. Investigating the importance of PAH VNTR marker in the diagnosis of phenylketonuria disease carriers in Isfahan population. Genetics in the Third Millennium. 2009; 6(4):1477. [Link]
13.Parivar K, Seifati SM, Koochmeshgi J. [Studying the level of informativity of VNTR marker on PAH gene for carrier detection of the patients with phenylketonuria in Yazd province, Iran (Persian)]. Medical Science Journal of Islamic Azad Univesity-Tehran Medical Branch. 2011; 21(3): 196-200. [Link]
14.Bagheri M, Abdi Rad I, Hosseini Jazani N, Zarrin R, Ghazavi A. Frequency of the VNTR- Polymorphisms at the PAH gene in the Iranian Azeri Turkish Patients with phenylketonuria. MAEDICA - A Journal of Clinical Medicine.2015; 10(4):310-4. [Link]
15.Alibakhshi R, Moradi K, Biglari M, Shafieenia S. Spectrum of phenylalanine hydroxylase gene mutations in Hamadan and Lorestan Provinces of Iran and their associations with variable number of tandem repeat alleles. Iranian Journal of Medical Sciences. 2018; 43(3):318-23. [Link]
16.Alibakhshi R, Moradi K, Ghadiri K. The status of PAH gene-VNTR alleles and mini-haplotypes associations with PAH gene mutations in Iranian Kurdish PKU patients. Medical Journal of The Islamic Republic of Iran. 2019; 33:88 [DOI:10.47176/mjiri.33.88] [PMID] [PMCID]
17.Zamanfar D, Jalali H, Mahdavi MR, Maadanisani M, Zaeri H, Asadpoor E. Investigation of five common mutations on phenylalanine hydroxylase gene of phenylketonuria patients from two provinces in North of Iran. International Journal of Preventive Medicine. 2017; 8:89. [PMID]
18.Khazaei Koohpar Z, Qasemiyan Y, Haerian Ardakani H, Hashemi M, Kimiajou M, Mohammadian S, et al. Mutation spectrum of the phenylalanine hydroxylase gene in phenylketonuria patients in Golestan Province, Iran. Biology Bulletin. 2020; 47(6):569-75. [Link]
19.Pronina N, Lugoveska R. Association between minihaplotypes and mutations at the phenylalanine hydroxylase locus in Latvian phenylketonuria patients PKU. Proceedings of The Latvian Academy of Sciences. 2011; 65(3-4):73-9. [DOI:10.2478/v10046-011-0021-5]
1.Bagheri M, Abdi Rad I, Hosseini Jazani N, Zarrin R, Ghazavi A. Association Between PAH Mutations and VNTR Alleles in the West Azerbaijani PKU Patients . MAEDICA: A Journal of Clinical Medicine. 2014; 9(3):242-7. [Link]
2.Nemati H, Karimi Yousefi SS, Pourvatan N, Aparviz R, Farzaneh P, Khazaei Koohpar Z, et al. Mutation analysis of phenylketonuria in the north of Iran. Gene Reports. 2021; 24:101196. [DOI:10.1016/j.genrep.2021.101196]
3.Hosseini-Mazinani SM, Koochmeshgi J, Khazaee-Koohpar Z, HoseinPur-Nobari N, Seifati SM. Carrier detection of phenylketonuria in Iranian families by variable number tandem-repeat polymorphism analysis. EMHJ-Eastern Mediterranean Health Journal. 2008; 14(6):1445-51. [Link]
4.Jafarzadeh-Esfehani R, Vojdani S, Hashemian S, Mirinezhad M, Pourafshar M, Forouzanfar N, et al. Genetic variants of the phenylalanine hydroxylase gene in patients with phenylketonuria in the northeast of Iran. Journal of Pediatric Endocrinology & Metabolism. 2020; 33(3):355-9. [DOI:10.1515/jpem-2019-0351] [PMID]
5.Gundorova P, Zinchenko RA, Makaov AK, Polyakov AV. The spectrum of mutations in the PAH gene in patients with hyperphenylalaninemia from the Karachay-Cherkess Republic. Russian Journal of Genetics. 2017; 53(7):813-9. [Link]
6.Hillert A, Anikster Y, Belanger-Quintana A, Burlina A, Burton BK, Carducci C, et al. The genetic landscape and epidemiology of Phenylketonuria. American Journal of Human Genetics. 2020; 107(2):234-250. [DOI:10.1016/j.ajhg.2020.06.006] [PMID] [PMCID]
7.Zarinkoob M, Khazaei Koohpar Z. Mutation analysis of exon 5 of PAH gene in phenylketonuria patients from Golestan Province, Iran. Journal of Shahrekord University of Medical Sciences. 2022; 24(1):15-9. [DOI:10.34172/jsums.2022.03]
8.Rastegar Moghadam M, Shojaei A, Babaei V, Rohani F, Ghazi F. Mutation analysis of Phenylalanine hydroxylase gene in Iranian patients with Phenylketonuria. Medical Journal of The Islamic Republic of Iran. 2018; 32:21. [DOI:10.14196/mjiri.32.21] [PMID] [PMCID]
9.Razipour M, Alavinejad E, Sajedi SZ, Talebi S, Entezam M, Mohajer N, et al. Genetic study of the PAH locus in the Iranian population: Familial gene mutations and minihaplotypes. Metabolic Brain Disease. 2017; 32(5):1685-91. [DOI:10.1007/s11011-017-0048-7] [PMID]
10.Abedini G, Khazaei Koohpar Z. Identifying variable number of tandem repeat alleles in phenylalanine hydroxylase gene in patients with phenylketonuria in Golestan Province, Iran. Journal of Advances in Medical and Biomedical Research. 2020; 28(129):198-203. [Link]
11.Eisensmith RC, Goltsov AA, Woo SL.A simple, rapid, and highly informative PCR-based procedure for prenatal diagnosis and carrier screening of phenylketonuria. Prenatal Diagnosis. 1994; 14 (12):1113-8. [DOI:10.1002/pd.1970141204]] [PMID]
12.Valian Borojeni S, Ebrahimi E. Investigating the importance of PAH VNTR marker in the diagnosis of phenylketonuria disease carriers in Isfahan population. Genetics in the Third Millennium. 2009; 6(4):1477. [Link]
13.Parivar K, Seifati SM, Koochmeshgi J. [Studying the level of informativity of VNTR marker on PAH gene for carrier detection of the patients with phenylketonuria in Yazd province, Iran (Persian)]. Medical Science Journal of Islamic Azad Univesity-Tehran Medical Branch. 2011; 21(3): 196-200. [Link]
14.Bagheri M, Abdi Rad I, Hosseini Jazani N, Zarrin R, Ghazavi A. Frequency of the VNTR- Polymorphisms at the PAH gene in the Iranian Azeri Turkish Patients with phenylketonuria. MAEDICA - A Journal of Clinical Medicine.2015; 10(4):310-4. [Link]
15.Alibakhshi R, Moradi K, Biglari M, Shafieenia S. Spectrum of phenylalanine hydroxylase gene mutations in Hamadan and Lorestan Provinces of Iran and their associations with variable number of tandem repeat alleles. Iranian Journal of Medical Sciences. 2018; 43(3):318-23. [Link]
16.Alibakhshi R, Moradi K, Ghadiri K. The status of PAH gene-VNTR alleles and mini-haplotypes associations with PAH gene mutations in Iranian Kurdish PKU patients. Medical Journal of The Islamic Republic of Iran. 2019; 33:88 [DOI:10.47176/mjiri.33.88] [PMID] [PMCID]
17.Zamanfar D, Jalali H, Mahdavi MR, Maadanisani M, Zaeri H, Asadpoor E. Investigation of five common mutations on phenylalanine hydroxylase gene of phenylketonuria patients from two provinces in North of Iran. International Journal of Preventive Medicine. 2017; 8:89. [PMID]
18.Khazaei Koohpar Z, Qasemiyan Y, Haerian Ardakani H, Hashemi M, Kimiajou M, Mohammadian S, et al. Mutation spectrum of the phenylalanine hydroxylase gene in phenylketonuria patients in Golestan Province, Iran. Biology Bulletin. 2020; 47(6):569-75. [Link]
19.Pronina N, Lugoveska R. Association between minihaplotypes and mutations at the phenylalanine hydroxylase locus in Latvian phenylketonuria patients PKU. Proceedings of The Latvian Academy of Sciences. 2011; 65(3-4):73-9. [DOI:10.2478/v10046-011-0021-5]
نوع مطالعه: پژوهشی |
موضوع مقاله:
علوم پايه پزشكي
دریافت: 1401/5/23 | پذیرش: 1401/7/1 | انتشار: 1401/7/1
دریافت: 1401/5/23 | پذیرش: 1401/7/1 | انتشار: 1401/7/1
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |