

دوره 27، شماره 4 - ( پاییز 1400 )
جلد 27 شماره 4 صفحات 565-550 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Gozali M, Ahmadizadeh C. Evaluation of Changes in NFKB Gene Expression Following Epstein-barr Virus and Its Participation in the Half-life of Patients With Acute Epstein-Barr Positive Lymphoblastic Leukemia. Intern Med Today 2021; 27 (4) :550-565
URL: http://imtj.gmu.ac.ir/article-1-3615-fa.html
URL: http://imtj.gmu.ac.ir/article-1-3615-fa.html
گوزلی مینا، احمدی زاده چنگیز. بررسی تغییرات بیان ژن NF-kB به دنبال ویروس اپشتینبار و مشارکت آن در نیمهعمر بیماران لوسمی لنفوبلاستیک حاد اپشتینبار مثبت. طب داخلی روز. 1400; 27 (4) :550-565
1- گروه میکروبیولوژی، دانشکده علوم پایه، واحد اهر، دانشگاه آزاد اسلامی، اهر، ایران.
2- گروه میکروبیولوژی، دانشکده علوم پایه، واحد اهر، دانشگاه آزاد اسلامی، اهر، ایران. ،dr_ahmadizadeh@yahoo.com
2- گروه میکروبیولوژی، دانشکده علوم پایه، واحد اهر، دانشگاه آزاد اسلامی، اهر، ایران. ،
متن کامل [PDF 4950 kb]
(1109 دریافت)
| چکیده (HTML) (2304 مشاهده)
References
1.Kliegman R, Stanton B, Geme JSt, Schor NF. Nelson Textbook of Pediatrics. 20th ed. Amsterdam: Elsevier; 2016.
2.Lanzkowsky Ph. Manual of pediatric hematology and oncology. 5th ed. Amsterdam: Elsevier; 2010.
3.Ahmed HG, Osman SI, Ashankyty IM. Incidence of epstein-barr virus in pediatric leukemia in the Sudan. Clinical Lymphoma, Myeloma & Leukemia. 201SSS2; 12(2):127-31. [DOI:10.1016/j.clml.2011.11.006] [PMID]
4.Bogdanovic G, Jernberg AG, Priftakis P, Grillner L, Gustafsson B. Human herpes virus 6 or epstein-barr virus were not detected in guthrie cards from children who later developed leukaemia. British Journal of Cancer. 2004; 91:913-5. [DOI:10.1038/sj.bjc.6602099]
5.Borges E, Ferry JA, Friedmann AM. Epstein-barr virus-negative precursor B cell lymphoblastic lymphoma after liver transplantation: A unique form of posttransplant lymphoproliferative disease. Transplantation. 2002; 73(4):541-3. [DOI:10.1097/00007890-200202270-00008] [PMID]
6.Szymula A. Genetic analysis of the role of Epstein-Barr Virus Nuclear Antigen Leader Protein (EBNA-LP) in B cell transformation. [PhD. Dissertation]. London. Imperial College London; 2016. [DOI:10.25560/44554] https://ethos.bl.uk/OrderDetails.do?uin=uk.bl.ethos.705836
7.Fasan O, Willmott C, Czepulkowski B, Baker A, Rees D, Salisbury J, et al. Epstein-barr virus-related post-transplant lymphoproliferative disorder with t(9;14)(p11-12;q32). Cancer Genet Cytogenet. 2003; 142(2):134-6. [DOI:10.1016/s0165-4608(02)00838-5] [PMID]
8.Huang J, Chen H, Hutt-Fletcher L, Ambinder RF, Hayward SD. Lytic viral replication as a contributor to the detection of epstein-barr virus in breast cancer. Journal Virology. 2003; 77(24):13267-74. [DOI:10.1128/jvi.77.24.13267-13274.2003] [PMID] [PMCID]
9.Kawabata Y, Hirokawa M, Saitoh Y, Kosugi S, Yoshioka T, Fujishima M, et al. Late-onset fatal epstein-barr virus-associated hemophagocytic syndrome following cord blood cell transplantation for adult acute lymphoblastic leukemia. International Journal of Hematology. 2006; 84(5):445-8. [DOI:10.1532/IJH97.06101] [PMID]
10.Levine RL. Inherited susceptibility to pediatric acute lymphoblastic leukemia. Nature Genetics. 2009; 41(9):957-8. [DOI:10.1038/ng0909-957] [PMID]
11.Woods JA, Vieira VJ, Keylock KT. Exercise, inflammation, and innate immunity. Immunology & Allergy Clinics of North America. 2009; 29(2):381-93. [DOI:10.1016/j.iac.2009.02.011] [PMID]
12.Mattson MP, Camandola S. NF-kappaB in neuronal plasticity and neurodegenerative disorders. Journal Clinical Investigation. 2001; 107(3):247-54. [DOI:10.1172/JCI11916] [PMID] [PMCID]
13.Culver C, Sundqvist A, Mudie S, Melvin A, Xirodimas D, Rocha S. Mechanism of hypoxia-induced NF-kappaB. Molecular and Celluler Biology Biol. 2010; 30(20):4901-21. [DOI:10.1128/MCB.00409-10] [PMID] [PMCID]
14.Takada Y, Andreeff M, Aggarwal BB. Indole-3-carbinol suppresses NF-kappaB and IkappaBalpha kinase activation, causing inhibition of expression of NF-kappaB-regulated antiapoptotic and metastatic gene products and enhancement of apoptosis in myeloid and leukemia cells. Blood. 2005; 106(2):641-9. [DOI:10.1182/blood-2004-12-4589] [PMID] [PMCID]
15.Lehtinen M, Koskela P, Ogmundsdottir HM, Bloigu A, Dillner J, Gudnadottir M, et al. Maternal herpesvirus infections and risk of acute lymphoblastic leukemia in the offspring. American Journal of Epidemiology. 2003; 158(3):207-13. [DOI:10.1093/aje/kwg137] [PMID]
16.Rojkind M, Domínguez-Rosales JA, Nieto N, Greenwel P. Role of hydrogen peroxide and oxidative stress in healing responses. Cellular and Molecular Life Sciences. 2002; 59(11):1872-91. [DOI:10.1007/pl00012511] [PMID]
17.Mitrus AJ, Rosenthal DS. Adult leukemias. In: Holleb AI, Fink DJ, Murphy GP, editors. American society textbook of clinical oncology. Atlanta: The American Cancer Society; 1991.
18.Pui CH, Relling MV, Downing JR. Acute lymphoblastic leukemia. New England Journal of Medicine. 2004; 350(15):1535-48. [DOI:10.1056/NEJMra023001] [PMID]
19.Akramipour R, Pedram M, Zandian K, Hashemi A. [A 5-Year- study on Children with Acute Myelocytic Leukemia/AML, Ahvaz Shafa Hospital (1996-2001) (Persian)]. Journal of Kermanshah University of Medical Sciences. 2007;11(2):e80674. https://sites.kowsarpub.com/jkums/articles/80674.html
20.Shih VF, Tsui R, Caldwell A, Hoffmann A. A single NFκB system for both canonical and non-canonical signaling. Cell Research. 2011; 21(1):86-102. [DOI:10.1038/cr.2010.161] [PMID] [PMCID]
21.Narayanan A, Amaya M, Voss K, Chung M, Benedict A, Sampey G, et al. Reactive oxygen species activate NFκB (p65) and p53 and induce apoptosis in RVFV infected liver cells. Virology. 2014; 449:270-86. [DOI:10.1016/j.virol.2013.11.023] [PMID]
22.Chinni SR, Li Y, Upadhyay S, Koppolu PK, Sarkar FH. Indole-3-carbinol (I3C) induced cell growth inhibition, G1 cell cycle arrest and apoptosis in prostate cancer cells. Oncogene. 2001; 20(23):2927-36. [DOI:10.1038/sj.onc.1204365] [PMID]
23.Salvatore C, Camarda G, Maggi CA, Goso C, Manzini S, Binaschi M. NF-kappaB activation contributes to anthracycline resistance pathway in human ovarian carcinoma cell line A2780. International Journal of Oncology. 2005; 27(3):799-806. [PMID]
24.Adcock IM. Transcription factors as activators of gene transcription: AP-1 and NF-kappa B. Monaldi Archives for Chest Disease. 1997; 52(2):178-86. [PMID]
25.Go HS, Seo JE, Kim KC, Han SM, Kim P, Kang YS, et al. Valproic acid inhibits neural progenitor cell death by activation of NF-κB signaling pathway and up-regulation of Bcl-XL. Journal of Biomedical Science. 2011; 18(1):48. [DOI:10.1186/1423-0127-18-48] [PMID] [PMCID]
26.Salmerón A, Janzen J, Soneji Y, Bump N, Kamens J, Allen H, et al. Direct phosphorylation of NF-kappaB1 p105 by the IkappaB kinase complex on serine 927 is essential for signal-induced p105 proteolysis. Journal of Biological Chemistry. 2001; 276(25):22215-22. [DOI:10.1074/jbc.M101754200] [PMID]
27.Rothe M, Sarma V, Dixit VM, Goeddel DV. TRAF2-mediated activation of NF-kappa B by TNF receptor 2 and CD40. Science. 1995; 269(5229):1424-7. [DOI:10.1126/science.7544915] [PMID]
28.Sugano N, Chen W, Roberts ML, Cooper NR. Epstein-barr virus binding to CD21 activates the initial viral promoter via NF-kappaB induction. Journal of Experimental Medicine. 1997; 186(5):731-7. [DOI:10.1084/jem.186.5.731] [PMID] [PMCID]
29.Cahir-McFarland ED, Carter K, Rosenwald A, Giltnane JM, Henrickson SE, Staudt LM, et al. Role of NF-kappa B in cell survival and transcription of latent membrane protein 1-expressing or Epstein-barr virus latency III-infected cells. Journal of Virology. 2004; 78(8):4108-19. [DOI:10.1128/jvi.78.8.4108-4119.2004] [PMID] [PMCID]
30.Li Q, Verma IM. NF-kappaB regulation in the immune system. Nature Reviews Immunology. 2002; 2(10):725-34. [DOI:10.1038/nri910] [PMID]
31.Safa M, Tavasoli B, Manafi R, Kiani F, Kashiri M, Ebrahimi S, et al. [Indole-3-carbinol suppresses NF-κB activity and stimulates the p53 pathway in pre-B acute lymphoblastic leukemia cells (Persian)]. Tumour Biology. 2015; 36(5):3919-30. [DOI:10.1007/s13277-014-3035-1] [PMID]
32.Poglio S, Cahu X, Uzan B, Besnard-Guérin C, Lapillonne H, Leblanc T, et al. Rapid childhood T-aLL growth in xenograft models correlates with mature phenotype and NF-κB pathway activation but not with poor prognosis. Leukemia. 2015; 29(4):977-80. [DOI:10.1038/leu.2014.317] [PMID]
متن کامل: (3277 مشاهده)
مقدمه
لوسمی یکی از شایعترین بدخیمیهای دوران کودکی است که حدود 40 کودک در هر میلیون کودک زیر 15 سال را مبتلا میکند. لوسمی لنفوبلاستیک حاد (ALL) حدود 75 درصد این موارد از لوسمی را شامل میشود. لوسمی لنفوبلاستیک حاد بر اساس رده سلولی T یا B تقسیمبندی میشود. علائم و نشانههای لوسمی حاد با ارتشاح سلولهای لوسمی در بافتهای طبیعی ارتباط دارد و موجب بروز نارساییهای مغز استخوان یا ارتشاح بافتی اختصاصی میشود. علائم شایع شامل تب، رنگپریدگی، پتشی یا اکیموز، احساس کسالت، بیاشتهایی و درد استخوان یا مفاصل هستند [1, 2]. لوسمی حاد شایعترین نوع بدخیمی در کودکان است و حدود30 درصد از تمام بدخیمیهای دوران کودکی را تشکیل میدهد. آمار نشان میدهد 4 نفر از هر 100 هزار کودک زیر 15 سال مبتلا به لوسمی حاد هستند. 77 درصد لوسمیهای کودکان از نوع لنفوبلاستیک حاد و 11 درصد از نوع میلوبلاستیک بوده و 12 درصد از سایر انواع لوسمی است [3]. لوسمی حاد لنفوبلاستیک (ALL)، نوعی از لوسمی یا سرطان سلولهای سفید خون است. ALL باعث آسیب و مرگ سلولهای طبیعی مغز استخوان و انتشار آن به ارگانهای دیگر میشود. اگرچه این بیماری در دوران کودکی و درسنین دو تا پنجسالگی شایعتر است، در افراد بیش از 60 سال نیز دیده میشود. در لوسمی لنفوبلاستیک حاد پیشسازهای لنفوسیتهای B و T درگیر میشوند. جهش در پروتوانکوژنها و تبدیل آنها به انکوژن از عوامل مؤثر در ایجاد بدخیمیهاست. شیوع آن در جنس مذکر بیشتر از مؤنث است [4, 5]. اپشتینبار ویروس (EBV) یک ویروس تومورزا و عضوی از خانواده هرپس ویریدههاست. ویروس اپشتینبار از یک ژنوم دورشتهای تقریباً به درازی kb-172 تشکیل یافته که بیش از 80 ژن و RNAهای غیرکدشونده را رمزگذاری میکند. این ویروس، ویروسی خطی است، اما به صورت اپیزوم در هسته سلولهای عفونی به شکل حلقوی درمیآید. EBV با بسیاری از بیماریهای بدخیم لنفوم، کارسینومها و همچنین بسیاری از بیماریهای خوشخیم نظیر مونونوکلئوز عفونی مرتبط است و همچنین به عنوان یک پروموتور فاکتور برای برخی از بیماریهای خودایمنی محسوب میشود. درمجموع برآورد میشود که حدود 1 تا 1/5 درصد از فراوانی سرطان در سرتاسر جهان مختص به EBV است [6]. ویروس اپشتینبار حدود 90 درصد از جمعیت را عفونی میکند و عفونت اولیه در خردسالان است و ممکن است سبب عفونت مونونوکلئوزیس شود [7]. در بیشتر افراد، ویروس در سلولهای B نهفته میشود و عواقب سلامتی تشخیص داده نمیشود. با این حال این ویروس با لیستی از بیماریهای بدخیم با منشأ لنفوئیدی یا پوششی همانند لنفومای بورکیت، بیماری تکثیری لنفاوی پس از پیوند، لنفومای B در ایمنی، لنفومای هاجکین، لنفومای سلولهای کشنده طبیعی T، سرطان بینی حلقوی، لیومیوسارکوما در ایدز و زیرمجموعههای سرطان معده در ارتباط است. به علاوه ارتباط این ویروسها با نقاطی همانند سینه، ریه و پروستات گزارش شده است [8].
فاکتور هستهای کاپا بی (NF-κB) کمپلکس پروتئینی است که کنترل رونویسی DNA، تولید سایتوکاینها و نیمهعمر سلول را بر عهده دارد. این ژن در اکثر سلولها بیان میشود و تحت تأثیر فاکتورهای محیطی مختلف نظیر استرس، ویروسها و اشعه تغییر رفتار میدهد. NF-κB اصلیترین فاکتورها در تنظیم الگوی پاسخ ایمنی به عوامل میکروبی محسوب میشود. تنظیم نابجای این ژن در بیماریهای مختلف نظیر سرطانها دیده شده است [9, 10]. NF-κB یک عامل نسخهبرداری است که بیان ژنهای آنتیآپوپتوزیس را تنظیم کرده و کموکاینها و سایتوکاینهای پیشالتهابی را فعال میکند. درواقع، NF-κB یک میانجی کلیدی در سرطانزایی توسط التهاب است [11]. NF-κB به طور گسترده توسط سلولهای یوکاریوت به عنوان تنظیمکننده بیان ژنهایی که در تکثیر و بقا نقش دارند، مورد استفاده قرار میگیرد. از همین رو بسیاری از تومورهای انسانی دارای NF-κB غیرعادی و تنظیمنشده هستند، به اینگونه که در آنها NF-κB به صورت دائم فعال است. NF-κB فعال بیان ژنهایی را که تکثیر سلولی را فعال نگه میدارند، روشن میکند و از طرف دیگر سلول را در مقابل آپوپتوز حفظ مینماید. این فاکتور رونویسی در فعالیتهای متنوع سلولی دخیل بوده و در اعمال بیولوژیک متفاوت دارای نقشی حائز اهمیت است. از اعمال شناختهشده این فاکتور میتوان به تنظیم پاسخهای ایمنی و التهابی و تکثیر سلولی و برای خونسازی و NF-κB آپوپتوز اشاره کرد. NF-κB. از همین رو بسیاری از تومورهای انسانی دارای NF-κB غیرعادی و تنظیمنشده هستند، به اینگونه که در آنها NF-κB به صورت دائم فعال است [12 ,13]. تاکادا و همکاران نشان دادند آپوپتوز ناشی از فاکتور نکروزدهنده تومور (TNF) را از طریق سرکوب NF-κB در لوسمی سلول حاد انسانی سلول جورکات تقویت میکند [14]. لتینن و همکاران نتیجه گرفتند که فعال شدن عفونت ویروس هرپس مادرانه خطر ALL در فرزندان را افزایش میدهد. تنها مثبت بودن ایمونوگلوبولین EBV در مادران (EBV-immunoglobulin-G) با ریسک بسیار زیاد قابل توجه ALL در فرزندان همراه بوده است [15]. مطالعات پیشین نشان میدهند H2O2 یک القاکننده مؤثر در فعال شدن مسیر NF-κB است [16].
این مطالعه با هدف بررسی افزایش بیان NF-κB به دنبال ویروس EBV و مشارکت آن در نیمهعمر بیماران لوسمی لنفوبلاستیک حاد EBV مثبت انجام شد.
مواد و روشها
جامعه آماری
این پژوهش مورد شاهدی روی کودکان صفر تا 14 ساله مبتلا به لوسمی لنفوبلاستیک حاد مراجعهکننده به بیمارستان کودکان تبریز در سال 1398 انجام شد. حجم نمونه با استفاده از فرمول زیر و با در نظر گرفتن 0/1=P، فاصله اطمینان 95 درصد و میزان خطای قابل تحمل 0/04، تعداد 60 نفر (60 فرد سالم به عنوان کنترل و 60 بیمار مبتلا به لوسمی لنفوبلاستیک حاد) برآورد شد.
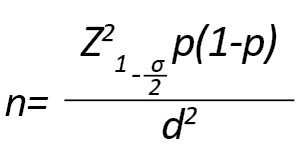
مشخصات هر بیمار پس از مراجعه، با کسب اجازه و رضایت از بیمار ثبت شد. معیارهای ورود به مطالعه برای گروه بیماران شامل تشخیص قطعی ابتلا به لوسمی لنفوبلاستیک حاد توسط متخصص انکولوژی و عدم سابقه عفونتهای حاد ویروسی، بیماریهای خودایمنی و اختلالات غدد درونریز بود. این بیماران قبل از شروع شیمیدرمانی مورد نمونهبرداری قرار گرفتند. سپس نمونهگیری از خون وریدی انجام گرفت. بدینترتیب که از هر فرد مقدار 2 سیسی خون گرفته شد و در لولههای فالکون حاوی EDTA، به عنوان ماده ضد انعقاد، ریخته شد و سپس لولهها به آرامی تکان داده شدند تا مخلوط شوند و از تشکیل لختههای خونی جلوگیری شود. این نمونهها نهایتاً به آزمایشگاه انتقال داده شده و داخل فریزر 80- درجه سانتیگراد نگهداری شدند. در ضمن خون 60 فرد سالم نیز به عنوان گروه کنترل، مانند نمونه بیمار گرفته شد.
استخراج RNA
به منظور استخراج RNA، سلولها توسط بافر ترایزول لیز شدند. لیزات سلولی حاصله به داخل میکروتیوبهای DNase/RNase –free منتقل شدند. سپس 200 میکرولیتر کلروفرم به میکروتیوب اضافه شد و در دور rpm 12000 به مدت 10 دقیقه سانتریفیوژ شد. در مرحله بعد، مایع رویی دور ریخته شد و به آن ایزوپروپانول 70 درصد اضافه شد. در روز بعد تیوپها به مدت 10 دقیقه و در rpm 12000 دور سانتریفیوژ شده و سپس مایع رویی دور ریخته شد و رسوب در دمای محیط خشک شد. در انتها، رسوب حاصل در 25 میکرولیتر حل شد. مقدار RNA استخراجشده به روش نوری و با استفاده از دستگاه NanoDrop (Wilmington, DE, USA) اندازهگیری شد و کیفیت RNA حاصله با روش الکتروفورز روی ژل مورد ارزیابی قرار گرفت.
الکتروفورز نمونه RNAهای استخراجشده
به منظور بررسی کیفیت RNAهای استخراجشده، پنج نمونه به صورت رندوم روی فرمالدئید ژل آگارز، الکتروفورز شدند. بدین منظور ابتدا ژل 0/8 ساخته شد و نمونهها پس از بسته شدن ژل روی ژل لود شدند و به مدت یک ساعت در ولتاژ 80 ولت الکتروفورز شدند.
آنالیز کمی RNA
آنالیز کمی RNA از طریق دستگاه نانو دراپ و با اندازهگیری جذب در 260 و 280 نانومتر انجام شد.
سنتز cDNA
ساخت مولکولهای DNA مکمل با کیت QuantiTect Reverse Transcription (شرکت کیاژن، ایران) انجام گرفت. پرایمرهای مورد استفاده توسط نرمافزار (Version 3.05) Gene runner طراحی شد و توسط وبسایتNCBI ،(www.ncbi.nlm.nih.gov) BLAST شدند که اطلاعات آنها در جدول شماره 1 موجود است.
.jpg)
پرایمرها توسط شرکت تکاپوزیست سنتز شدند.
Real time PCR
واکنش Real time PCR به صورت تکرارهای سهتایی صورت گرفت. بدین شکل که در تیوبهای مخصوص Real time PCR یک میکرولیتر cDNA و 19 میکرولیتر مسترمیکس سایبرگرین حاوی یک میکرولیتر پرایمر فوروارد (0/2 میکرومولار)، یک میکرولیتر پرایمر ریورز (0/2 میکرومولار)، 7 میکرولیتر DEPC و 10 میکرولیتر Mastermix 1x Real time ریخته شد. بعد تیوبها در دستگاه Real time PCR قرار داده شده و دستگاه run شد.
ایزولاسیون DNA ویروسی از نمونه بیماران مبتلا به لوسمی
برای بررسی متیلاسیون ژن NF-κB ،DNA توتال از بلوک پارافینه دریافتی طبق دستورالعمل شرکت Bioneer، سازنده کیت استخراج DNA از بلوک پارافینه به شماره کاتالوگ 740980.50 جداسازی شد و برای بررسی متیلاسیون ژنوم ویروس EBV ابتدا DNA ویروسی از نمونه بافت بیماران لوسمی لنفوبلاستیک حاد EBV مثبت به صورت زیر جداسازی شد: 200-1 نانوگرم از بافت هموژنشده داخل تیوپ 1/5 میلیلیتری انتقال یافت. 200μl از Lysis Buffer HL اضافه و به مدت 5 دقیقه در دمای اتاق انکوبه شد. 20μl از Proteinase K و 20μl از Carrier DNA، افزوده شد و میکس شد. افزودن کنترل داخلی از Binding Buffer HL به مقدار افزوده و مخلوط شد. به داخل RTA Spin Filter انتقال داده شد و به مدت یک دقیقه در دمای اتاق انکوبه شد. به مدت 2 دقیقه در 11000 rpm سانتریفیوژ انجام شد و مجدداً مخلوط به داخل RTA Spin Filter داخل RTA Receiver جدید انتقال داده شد. μl 500 از Wash Buffer I به RTA Spin Filter افزوده شد، به مدت یک دقیقه در rpm 11000 سانتریفیوژ شد و مجدداً مخلوط به داخل RTA Spin Filter جدید انتقال داده شد. μl 700 از Wash Buffer II افزوده شد و سانتریفیوژ شد، فیلتر جدا شده روی تیوپ قرار داده شد و RTA Spin Filter داخل تیوپ جدیدی انتقال داده شد. به مدت 4 دقیقه جهت حذف کامل اتانول در حداکثر سرعت سانتریفیوژ انجام شد و به مدت 15 دقیقه داخل فیلتر جدیدی انتقال داده شد. μl 100 از Elution Buffer که قبلاً تا °C 56 گرم شده بود، به داخل RTA Spin Filter افزوده شد و مخلوط در دمای اتاق به مدت یک دقیقه انکوبه شد.و سپس سانتریفوژ شد و DNA ویروسی در °C 4 یا در °C 20- ذخیرهسازی شد.
تعیین کمیت ویروس EBV
استانداردهای کمکی موجود در کیت داینابایو TM (DynaBio. Takapozist, Iran) به همان روش استخراج نمونه و با همان حجم، انجام شدند.
برای تولید یک منحنی استاندارد در RotorGene TM 2000/3000/6000، همه پنج استاندارد در منوی ویرایش نرمافزار RotorGene™ تعریف شدند. همان موارد نیز به عنوان استانداردهای با غلظتهای مشخصشده مورد استفاده قرار گرفتند.
فرمول زیر باید برای تبدیل مقادیر تعیینشده با استفاده از منحنی استاندارد به IU / ml نمونهها اعمال شود.

روش محاسبه آماری
پس از اتمام کارهای آزمایشگاهی با به کار بردن قانون هاردی وینبرگ میزان فراوانی مورد انتظار و مشاهدهشده، محاسبه و وارد محیط SPSS شد. برای مقایسه میانگین تعداد آللهای جهشیافته در جامعه مورد مطالعه از روش آنالیز واریانس استفاده شد. فرض صفر در آنالیز واریانس، برابر بودن میانگین متغیر وابسته در تمام سطوح متغیر مستقل است.
یافتهها
اطلاعات جمعیتشناختی جمعیت مورد مطالعه
در گروه بیماران، 24 نفر (41/4 درصد) مذکر و 36 نفر (58/6 درصد) مؤنث و در گروه کنترل نیز 24 نفر (41/4 درصد) مذکر و 36 نفر (58/6 درصد) مؤنث بودند. میانگین سنی در گروه بیمار 1/35±8/60 سال و در گروه سالم 1/46±7/74 سال بود. بین میانگین سنی گروه بیماران و گروه سالم از نظر آماری تفاوتی وجود نداشت (جدول شماره 2).
.jpg)
.jpg)
آنالیز کیفی RNA
به منظور تأیید کیفی RNA استخراجی، الکتروفورز نمونهها روی ژل 0/8 درصد آگارز انجام شد که در تصویر شماره 1 وجود باندهای 18s و 28s ریبوزومی نشان داده شده است.
لوسمی یکی از شایعترین بدخیمیهای دوران کودکی است که حدود 40 کودک در هر میلیون کودک زیر 15 سال را مبتلا میکند. لوسمی لنفوبلاستیک حاد (ALL) حدود 75 درصد این موارد از لوسمی را شامل میشود. لوسمی لنفوبلاستیک حاد بر اساس رده سلولی T یا B تقسیمبندی میشود. علائم و نشانههای لوسمی حاد با ارتشاح سلولهای لوسمی در بافتهای طبیعی ارتباط دارد و موجب بروز نارساییهای مغز استخوان یا ارتشاح بافتی اختصاصی میشود. علائم شایع شامل تب، رنگپریدگی، پتشی یا اکیموز، احساس کسالت، بیاشتهایی و درد استخوان یا مفاصل هستند [1, 2]. لوسمی حاد شایعترین نوع بدخیمی در کودکان است و حدود30 درصد از تمام بدخیمیهای دوران کودکی را تشکیل میدهد. آمار نشان میدهد 4 نفر از هر 100 هزار کودک زیر 15 سال مبتلا به لوسمی حاد هستند. 77 درصد لوسمیهای کودکان از نوع لنفوبلاستیک حاد و 11 درصد از نوع میلوبلاستیک بوده و 12 درصد از سایر انواع لوسمی است [3]. لوسمی حاد لنفوبلاستیک (ALL)، نوعی از لوسمی یا سرطان سلولهای سفید خون است. ALL باعث آسیب و مرگ سلولهای طبیعی مغز استخوان و انتشار آن به ارگانهای دیگر میشود. اگرچه این بیماری در دوران کودکی و درسنین دو تا پنجسالگی شایعتر است، در افراد بیش از 60 سال نیز دیده میشود. در لوسمی لنفوبلاستیک حاد پیشسازهای لنفوسیتهای B و T درگیر میشوند. جهش در پروتوانکوژنها و تبدیل آنها به انکوژن از عوامل مؤثر در ایجاد بدخیمیهاست. شیوع آن در جنس مذکر بیشتر از مؤنث است [4, 5]. اپشتینبار ویروس (EBV) یک ویروس تومورزا و عضوی از خانواده هرپس ویریدههاست. ویروس اپشتینبار از یک ژنوم دورشتهای تقریباً به درازی kb-172 تشکیل یافته که بیش از 80 ژن و RNAهای غیرکدشونده را رمزگذاری میکند. این ویروس، ویروسی خطی است، اما به صورت اپیزوم در هسته سلولهای عفونی به شکل حلقوی درمیآید. EBV با بسیاری از بیماریهای بدخیم لنفوم، کارسینومها و همچنین بسیاری از بیماریهای خوشخیم نظیر مونونوکلئوز عفونی مرتبط است و همچنین به عنوان یک پروموتور فاکتور برای برخی از بیماریهای خودایمنی محسوب میشود. درمجموع برآورد میشود که حدود 1 تا 1/5 درصد از فراوانی سرطان در سرتاسر جهان مختص به EBV است [6]. ویروس اپشتینبار حدود 90 درصد از جمعیت را عفونی میکند و عفونت اولیه در خردسالان است و ممکن است سبب عفونت مونونوکلئوزیس شود [7]. در بیشتر افراد، ویروس در سلولهای B نهفته میشود و عواقب سلامتی تشخیص داده نمیشود. با این حال این ویروس با لیستی از بیماریهای بدخیم با منشأ لنفوئیدی یا پوششی همانند لنفومای بورکیت، بیماری تکثیری لنفاوی پس از پیوند، لنفومای B در ایمنی، لنفومای هاجکین، لنفومای سلولهای کشنده طبیعی T، سرطان بینی حلقوی، لیومیوسارکوما در ایدز و زیرمجموعههای سرطان معده در ارتباط است. به علاوه ارتباط این ویروسها با نقاطی همانند سینه، ریه و پروستات گزارش شده است [8].
فاکتور هستهای کاپا بی (NF-κB) کمپلکس پروتئینی است که کنترل رونویسی DNA، تولید سایتوکاینها و نیمهعمر سلول را بر عهده دارد. این ژن در اکثر سلولها بیان میشود و تحت تأثیر فاکتورهای محیطی مختلف نظیر استرس، ویروسها و اشعه تغییر رفتار میدهد. NF-κB اصلیترین فاکتورها در تنظیم الگوی پاسخ ایمنی به عوامل میکروبی محسوب میشود. تنظیم نابجای این ژن در بیماریهای مختلف نظیر سرطانها دیده شده است [9, 10]. NF-κB یک عامل نسخهبرداری است که بیان ژنهای آنتیآپوپتوزیس را تنظیم کرده و کموکاینها و سایتوکاینهای پیشالتهابی را فعال میکند. درواقع، NF-κB یک میانجی کلیدی در سرطانزایی توسط التهاب است [11]. NF-κB به طور گسترده توسط سلولهای یوکاریوت به عنوان تنظیمکننده بیان ژنهایی که در تکثیر و بقا نقش دارند، مورد استفاده قرار میگیرد. از همین رو بسیاری از تومورهای انسانی دارای NF-κB غیرعادی و تنظیمنشده هستند، به اینگونه که در آنها NF-κB به صورت دائم فعال است. NF-κB فعال بیان ژنهایی را که تکثیر سلولی را فعال نگه میدارند، روشن میکند و از طرف دیگر سلول را در مقابل آپوپتوز حفظ مینماید. این فاکتور رونویسی در فعالیتهای متنوع سلولی دخیل بوده و در اعمال بیولوژیک متفاوت دارای نقشی حائز اهمیت است. از اعمال شناختهشده این فاکتور میتوان به تنظیم پاسخهای ایمنی و التهابی و تکثیر سلولی و برای خونسازی و NF-κB آپوپتوز اشاره کرد. NF-κB. از همین رو بسیاری از تومورهای انسانی دارای NF-κB غیرعادی و تنظیمنشده هستند، به اینگونه که در آنها NF-κB به صورت دائم فعال است [12 ,13]. تاکادا و همکاران نشان دادند آپوپتوز ناشی از فاکتور نکروزدهنده تومور (TNF) را از طریق سرکوب NF-κB در لوسمی سلول حاد انسانی سلول جورکات تقویت میکند [14]. لتینن و همکاران نتیجه گرفتند که فعال شدن عفونت ویروس هرپس مادرانه خطر ALL در فرزندان را افزایش میدهد. تنها مثبت بودن ایمونوگلوبولین EBV در مادران (EBV-immunoglobulin-G) با ریسک بسیار زیاد قابل توجه ALL در فرزندان همراه بوده است [15]. مطالعات پیشین نشان میدهند H2O2 یک القاکننده مؤثر در فعال شدن مسیر NF-κB است [16].
این مطالعه با هدف بررسی افزایش بیان NF-κB به دنبال ویروس EBV و مشارکت آن در نیمهعمر بیماران لوسمی لنفوبلاستیک حاد EBV مثبت انجام شد.
مواد و روشها
جامعه آماری
این پژوهش مورد شاهدی روی کودکان صفر تا 14 ساله مبتلا به لوسمی لنفوبلاستیک حاد مراجعهکننده به بیمارستان کودکان تبریز در سال 1398 انجام شد. حجم نمونه با استفاده از فرمول زیر و با در نظر گرفتن 0/1=P، فاصله اطمینان 95 درصد و میزان خطای قابل تحمل 0/04، تعداد 60 نفر (60 فرد سالم به عنوان کنترل و 60 بیمار مبتلا به لوسمی لنفوبلاستیک حاد) برآورد شد.
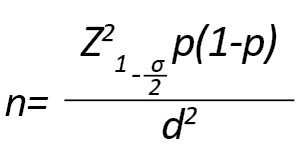
مشخصات هر بیمار پس از مراجعه، با کسب اجازه و رضایت از بیمار ثبت شد. معیارهای ورود به مطالعه برای گروه بیماران شامل تشخیص قطعی ابتلا به لوسمی لنفوبلاستیک حاد توسط متخصص انکولوژی و عدم سابقه عفونتهای حاد ویروسی، بیماریهای خودایمنی و اختلالات غدد درونریز بود. این بیماران قبل از شروع شیمیدرمانی مورد نمونهبرداری قرار گرفتند. سپس نمونهگیری از خون وریدی انجام گرفت. بدینترتیب که از هر فرد مقدار 2 سیسی خون گرفته شد و در لولههای فالکون حاوی EDTA، به عنوان ماده ضد انعقاد، ریخته شد و سپس لولهها به آرامی تکان داده شدند تا مخلوط شوند و از تشکیل لختههای خونی جلوگیری شود. این نمونهها نهایتاً به آزمایشگاه انتقال داده شده و داخل فریزر 80- درجه سانتیگراد نگهداری شدند. در ضمن خون 60 فرد سالم نیز به عنوان گروه کنترل، مانند نمونه بیمار گرفته شد.
استخراج RNA
به منظور استخراج RNA، سلولها توسط بافر ترایزول لیز شدند. لیزات سلولی حاصله به داخل میکروتیوبهای DNase/RNase –free منتقل شدند. سپس 200 میکرولیتر کلروفرم به میکروتیوب اضافه شد و در دور rpm 12000 به مدت 10 دقیقه سانتریفیوژ شد. در مرحله بعد، مایع رویی دور ریخته شد و به آن ایزوپروپانول 70 درصد اضافه شد. در روز بعد تیوپها به مدت 10 دقیقه و در rpm 12000 دور سانتریفیوژ شده و سپس مایع رویی دور ریخته شد و رسوب در دمای محیط خشک شد. در انتها، رسوب حاصل در 25 میکرولیتر حل شد. مقدار RNA استخراجشده به روش نوری و با استفاده از دستگاه NanoDrop (Wilmington, DE, USA) اندازهگیری شد و کیفیت RNA حاصله با روش الکتروفورز روی ژل مورد ارزیابی قرار گرفت.
الکتروفورز نمونه RNAهای استخراجشده
به منظور بررسی کیفیت RNAهای استخراجشده، پنج نمونه به صورت رندوم روی فرمالدئید ژل آگارز، الکتروفورز شدند. بدین منظور ابتدا ژل 0/8 ساخته شد و نمونهها پس از بسته شدن ژل روی ژل لود شدند و به مدت یک ساعت در ولتاژ 80 ولت الکتروفورز شدند.
آنالیز کمی RNA
آنالیز کمی RNA از طریق دستگاه نانو دراپ و با اندازهگیری جذب در 260 و 280 نانومتر انجام شد.
سنتز cDNA
ساخت مولکولهای DNA مکمل با کیت QuantiTect Reverse Transcription (شرکت کیاژن، ایران) انجام گرفت. پرایمرهای مورد استفاده توسط نرمافزار (Version 3.05) Gene runner طراحی شد و توسط وبسایتNCBI ،(www.ncbi.nlm.nih.gov) BLAST شدند که اطلاعات آنها در جدول شماره 1 موجود است.
.jpg)
پرایمرها توسط شرکت تکاپوزیست سنتز شدند.
Real time PCR
واکنش Real time PCR به صورت تکرارهای سهتایی صورت گرفت. بدین شکل که در تیوبهای مخصوص Real time PCR یک میکرولیتر cDNA و 19 میکرولیتر مسترمیکس سایبرگرین حاوی یک میکرولیتر پرایمر فوروارد (0/2 میکرومولار)، یک میکرولیتر پرایمر ریورز (0/2 میکرومولار)، 7 میکرولیتر DEPC و 10 میکرولیتر Mastermix 1x Real time ریخته شد. بعد تیوبها در دستگاه Real time PCR قرار داده شده و دستگاه run شد.
ایزولاسیون DNA ویروسی از نمونه بیماران مبتلا به لوسمی
برای بررسی متیلاسیون ژن NF-κB ،DNA توتال از بلوک پارافینه دریافتی طبق دستورالعمل شرکت Bioneer، سازنده کیت استخراج DNA از بلوک پارافینه به شماره کاتالوگ 740980.50 جداسازی شد و برای بررسی متیلاسیون ژنوم ویروس EBV ابتدا DNA ویروسی از نمونه بافت بیماران لوسمی لنفوبلاستیک حاد EBV مثبت به صورت زیر جداسازی شد: 200-1 نانوگرم از بافت هموژنشده داخل تیوپ 1/5 میلیلیتری انتقال یافت. 200μl از Lysis Buffer HL اضافه و به مدت 5 دقیقه در دمای اتاق انکوبه شد. 20μl از Proteinase K و 20μl از Carrier DNA، افزوده شد و میکس شد. افزودن کنترل داخلی از Binding Buffer HL به مقدار افزوده و مخلوط شد. به داخل RTA Spin Filter انتقال داده شد و به مدت یک دقیقه در دمای اتاق انکوبه شد. به مدت 2 دقیقه در 11000 rpm سانتریفیوژ انجام شد و مجدداً مخلوط به داخل RTA Spin Filter داخل RTA Receiver جدید انتقال داده شد. μl 500 از Wash Buffer I به RTA Spin Filter افزوده شد، به مدت یک دقیقه در rpm 11000 سانتریفیوژ شد و مجدداً مخلوط به داخل RTA Spin Filter جدید انتقال داده شد. μl 700 از Wash Buffer II افزوده شد و سانتریفیوژ شد، فیلتر جدا شده روی تیوپ قرار داده شد و RTA Spin Filter داخل تیوپ جدیدی انتقال داده شد. به مدت 4 دقیقه جهت حذف کامل اتانول در حداکثر سرعت سانتریفیوژ انجام شد و به مدت 15 دقیقه داخل فیلتر جدیدی انتقال داده شد. μl 100 از Elution Buffer که قبلاً تا °C 56 گرم شده بود، به داخل RTA Spin Filter افزوده شد و مخلوط در دمای اتاق به مدت یک دقیقه انکوبه شد.و سپس سانتریفوژ شد و DNA ویروسی در °C 4 یا در °C 20- ذخیرهسازی شد.
تعیین کمیت ویروس EBV
استانداردهای کمکی موجود در کیت داینابایو TM (DynaBio. Takapozist, Iran) به همان روش استخراج نمونه و با همان حجم، انجام شدند.
برای تولید یک منحنی استاندارد در RotorGene TM 2000/3000/6000، همه پنج استاندارد در منوی ویرایش نرمافزار RotorGene™ تعریف شدند. همان موارد نیز به عنوان استانداردهای با غلظتهای مشخصشده مورد استفاده قرار گرفتند.
فرمول زیر باید برای تبدیل مقادیر تعیینشده با استفاده از منحنی استاندارد به IU / ml نمونهها اعمال شود.

روش محاسبه آماری
پس از اتمام کارهای آزمایشگاهی با به کار بردن قانون هاردی وینبرگ میزان فراوانی مورد انتظار و مشاهدهشده، محاسبه و وارد محیط SPSS شد. برای مقایسه میانگین تعداد آللهای جهشیافته در جامعه مورد مطالعه از روش آنالیز واریانس استفاده شد. فرض صفر در آنالیز واریانس، برابر بودن میانگین متغیر وابسته در تمام سطوح متغیر مستقل است.
یافتهها
اطلاعات جمعیتشناختی جمعیت مورد مطالعه
در گروه بیماران، 24 نفر (41/4 درصد) مذکر و 36 نفر (58/6 درصد) مؤنث و در گروه کنترل نیز 24 نفر (41/4 درصد) مذکر و 36 نفر (58/6 درصد) مؤنث بودند. میانگین سنی در گروه بیمار 1/35±8/60 سال و در گروه سالم 1/46±7/74 سال بود. بین میانگین سنی گروه بیماران و گروه سالم از نظر آماری تفاوتی وجود نداشت (جدول شماره 2).
.jpg)
.jpg)
آنالیز کیفی RNA
به منظور تأیید کیفی RNA استخراجی، الکتروفورز نمونهها روی ژل 0/8 درصد آگارز انجام شد که در تصویر شماره 1 وجود باندهای 18s و 28s ریبوزومی نشان داده شده است.
حضور و کیفیت باندهای 18s و 28s ریبوزومی نمایانگر کیفیت RNA استخراجشده است.
آنالیز کمی RNA تیمارشده
پس از تیمار RNA استخراجشده به روش مذکور و به منظور بررسی کمی آن، آنالیز اسپکتروفوتومتری انجام شد تا از غلظت آنها اطمینان حاصل شود.
بررسی تغییر بیان ژنهای NF-kB در سلولهای لوسمی به روش Real time PCR
برای این منظور پس از انجام تنظیمات اولیه استخراج RNA صورت گرفت و پس از سنتز cDNA با بهکارگیری پرایمرها و پروب اختصاصی الگوی بیان مورد بررسی واقع شد.
مطالعه بیان ژن NF-kB در سلولهای لوسمی در مقایسه با نمونههای کنترل به وسیله Real time PCR
در نمونه لوسمی بیان ژن NF-κB مورد ارزیابی قرار گرفت. نتایج حاصل نشان داد بیان ژن NF-κB افزایش معنیداری در گروه بیمار لوسمی حاد لنفوبلاستیک پیدا میکند (P<0/05) (تصویر شماره 2).
آنالیز کمی RNA تیمارشده
پس از تیمار RNA استخراجشده به روش مذکور و به منظور بررسی کمی آن، آنالیز اسپکتروفوتومتری انجام شد تا از غلظت آنها اطمینان حاصل شود.
بررسی تغییر بیان ژنهای NF-kB در سلولهای لوسمی به روش Real time PCR
برای این منظور پس از انجام تنظیمات اولیه استخراج RNA صورت گرفت و پس از سنتز cDNA با بهکارگیری پرایمرها و پروب اختصاصی الگوی بیان مورد بررسی واقع شد.
مطالعه بیان ژن NF-kB در سلولهای لوسمی در مقایسه با نمونههای کنترل به وسیله Real time PCR
در نمونه لوسمی بیان ژن NF-κB مورد ارزیابی قرار گرفت. نتایج حاصل نشان داد بیان ژن NF-κB افزایش معنیداری در گروه بیمار لوسمی حاد لنفوبلاستیک پیدا میکند (P<0/05) (تصویر شماره 2).
نتایج حاصل از تغییرات بیان ژن NF-κB نشان داد ویروس EBV باعث کاهش بیان ژن NF-κB در گروههای EBV مثبت شد (0/041=P) (تصویر شماره 3).
بحث
نتایج این بررسی نشان داد میزان بیان ژن NF-κB افزایش معنیداری در گروه بیمار دارد و ویروس اپشتینبار باعث کاهش بیان ژن NF-κB در لوسمی لنفوبلاستیک حاد شده است. لوسمی لنفوبلاستیک حاد (ALL) نوعی سرطان است که بر لنفوسیتها و سلولهای تولیدکننده لنفوسیت در مغز استخوان تأثیر میگذارد. لنفوسیتها نوعی از گلبولهای سفید خون هستند که آنتیبادی تولید کرده و از بخشهای حیاتی سیستم ایمنی بدن هستند. لنفوسیتها برای عملکرد خود به زیرگروههایی تقسیم میشوند که عمدهترین آنها سلولهای B و T هستند. در ALL، تجمعی از سلولهای تشکیلدهنده لنفوسیت نابالغ به نام سلولهای بلاست در مغز استخوان دیده میشود. این سلولها، سلولهای طبیعی خون را تحت تأثیر قرار داده و نهایتاً باعث کاهش تولید گلبولهای قرمز، گلبولهای سفید و پلاکتهای خون میشوند. لوسمی لنفوبلاستیک حاد (ALL) شایعترین بدخیمی در دوران کودکی است که در 80 الی 85 درصد موارد در کودکان کمتر از شش سال بروز میکند [17]. پوئی و همکاران نیز در مطالعه خود در سال 2004 بیان کردند که درگیری عصبی در بیماران مبتلا به لوسمی نادر است [18]. همچنین در مطالعه اکرمیپور و همکاران که به بررسی پنجساله کودکان مبتلا به لوسمی حاد میلوئیدی در بیمارستان شفای اهواز پرداخته بودند، به درگیری کمتر از 5/3 درصد سیستم عصبی در این بیماران اشاره شده است [19].
NF-κB یک فاکتور رونویسی است که نقش مهمی در التهاب، پاسخهای ایمنی، ایمنی ذاتی و اکتسابی با تنظیم جنبههای مختلف تکامل و عمل سلولهای عملگر ایفا مینماید که با مطالعه ما همخوانی دارد [20]. بررسیهای انجامشده در سال 2013 توسط نارایانان و همکاران روی سلولهای HepG کبدی نشان داد در سلولهای آلوده به ویروس2 گونههای فعال اکسیژن افزایش پیدا کرده و منجر به فعال کردن مسیر NF-κB در مراحل ابتدایی بیماری شده است که با مطالعه ما همخوانی دارد [21]. نتایج مطالعات چینی در سال 2001 نشان میدهد I3C و ترکیبات حاصل از آن از طریق مهار فاکتور رونویسی NF-κB میتواند باعث القای آپوپتوز در سلولهای سرطانی مختلف شود که با مطالعه ما همخوانی ندارد [22]. سالواتور و همکاران در سال 2005 در مطالعه خود بیان کردند به دنبال تیمار سلولها با دوکسوروبیسین، این ترکیب از طریق اتصال به DNA دورشتهای و پایداری کمپلکس آنزیم توپوایزومراز II، مانع سنتز DNA شده و این مسئله منجر به القای آپوپتوز میشود. از سوی دیگر، در کنار این فرایند مسیر دیگری نیز فعال میشود که با بهکارگیری NF-κB و به دنبال آن فعال شدن ژنهای دخیل در بقای سلولی مانند Survivin ،IAP1-c و XIAP از مرگ سلولی جلوگیری میکند که با مطالعه ما همخوانی دارد [23]. نتایج حاصل از مطالعه آدکوک و همکاران در سال 1997 نشان داد فعال شدن NF-κB نقش مهمی را در فرایندهای التهابی، پاسخهای ایمنی و مرگ سلولی به واسطه اتصال به پروموتر ژنهای مختلف مانند TNFα ،1β-IL و سیکلواکسیژناز 2 بازی میکند که با مطالعه ما همخوانی ندارد [24]. گو و همکاران در سال 2011 بیان کردند که والپروات با افزایش استیلاسیون NF-κB نورونها را از استرس اکسیداتیو القاکننده مرگ سلولی محافظت کرده و دارای اثر محافظ عصبی است که با مطالعه ما همخوانی دارد [25]. در بررسی روی پروتئینهای حد واسط، از ژنهای کاهش بیان یافته، 170 پروتئین کیناز مرتبط مشاهده شد که از این تعداد، 62 عدد، اختصاصی ژنهای دسته کاهش بیان یافته، پیشبینی شدند و از بین 62 عدد کیناز (Inhibitor of Nuclear Factor Kappa-B Kinase Subunit (Beta) IKBKB بهترین امتیاز را گرفت که نقش مهمی در مسیر سیگنالینگ NF-κB ایفا میکند و این مسیر در آسیبهای واردشده به DNA، التهاب سایتوکاینها، تولید باکتریها و ویروسها فعال شده و با فعال کردن صدها ژن باعث پاسخ ایمنی، کنترل رشد و محافظت در مقابل آپوپتوز میشود که با مطالعه ما همخوانی دارد [26]. روته و همکاران در مطالعه خود بیان کردند که برخی از مولکولهایی که بیان آنها در سلولهای آلوده به EBV تنظیم میشود ممکن است در فعالسازی NF-κB نقش غیرمستقیم ایفا کنند. طبق گزارشها سلولهای SNK6 TNF-α را تولید میکنند که NF-κB را در سلولهای T و NK فعال میکند [27]. روته و همکاران در سال 1995 در مطالعات خود بیان کردند که NF-κB میتواند در پاییندست از CD40 و CD137 فعال شود. بیان CD40 یا CD137 ناشی از EBV ممکن است در فعالسازی NF-κB در سلولهای EBV-T / NK نقش داشته باشد که با مطالعه ما همخوانی ندارد [27]. سوگانو و همکاران در سال 1997 بیان کردند اتصال EBV فعالسازی NF-κB را آغاز میکند که برای عفونت موفقیتآمیز سلول لازم است. فعالیت NF-κB به نوبه خود، همچنین بیان مولکول CD21 را تنظیم میکند که ممکن است یک حلقه بازخورد مثبت برای تقویت حساسیت سلول به ورود EBV فراهم کند که با مطالعه ما همخوانی ندارد [28]. کاهیر مکفارلند و همکاران در سال 2004 در مطالعهای نشان دادند حذف فعالیت NF-κB باعث بروز آپوپتوز ردههای سلولی لنفوم آلوده به EBV در شرایط آزمایشگاهی و موش میشود و نشان میدهد که این یک مسیر اساسی است که توسط انکوپروتئینهای ویروسی ایجاد میشود که با مطالعه ما همخوانی دارد [29]. بین فعالسازی NF-κB و تکثیر سلولی در بازداشت چرخه سلولی رابطه وجود دارد. بر اساس تعادل نسبی بین عملکردهای بیولوژیکی و بیوشیمیایی NF-κB، همچنین نقش مهم NF-κB در مقاومت به آپوپتوز و کنترل تقسیم سلولهای بنیادی خونساز، اخیراً به خوبی مشخص شده است که NF-κB نیز در استرس اکسیداتیو نقش دارد. فعالسازی NF-κB مسئول فعال شدن اکسید نیتریک اکساید سنتاز (iNOS) برای افزایش اکسید نیتریک (NO) است که به عنوان یک عملکرد طرفدار آپوپتوز NF-κB توصیف شده است. الگوی تولید NO ممکن است بقای سلولی را کنترل کند، زیرا مشخص شد که تولید حاد NO باعث آپوپتوز میشود. اما از طرف دیگر، تولید مزمن NO با سیگنالینگ NF-κB سازنده فعال میتواند مکانیسم آپوپتوز را مهار کند که با مطالعه ما همخوانی دارد [30]. صفا و همکاران درسال 2015 در مطالعهای بیان کردند که در تومورزایی انسان، NF-κB یک عامل مهم در بقای سلولهای سرطانی است که با مطالعه ما همخوانی دارد [31]. پوگلیو و همکاران در سال 2015 در مطالعهای بیان کردند تغییرات در مسیر NF-κB بهویژه در ALL و سایر لوسمیها به رسمیت شناخته شده است؛ به عنوان مثال، تنظیم آن باید آپوپتوز سلولهای لوسمی را تسهیل کند که با مطالعه ما همخوانی دارد [32]. در یک مطالعه منتشرشده از لتینن و همکاران در سال 2003 نشان داده شد فعال شدن مجدد مادر از عفونت EBV در سهماهه اول با افزایش قابل توجهی در بروز ALL در فرزندان همراه است که با مطالعه ما همخوانی ندارد [15]. تاکادا و همکاران در سال 2005 نشان دادند آپوپتوز ناشی از TNF را از طریق سرکوب NF-κB در لوسمی سلول حاد انسانی سلول جورکات تقویت میکند که با مطالعه ما همخوانی دارد [14].
نتیجهگیری
ژن NF-κB میتواند به عنوان یک پیشآگهی تشخیص لوسمی لنفوبلاستیک حاد باشدکه نیاز به مطالعات بیشتر در این زمینه است. همچنین انجام مطالعات بیشتر در مورد عفونت EBV و بیماری لنفوبلاستیک حاد ضروری است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
رضایت آگاهانه از بیماران و خانوادههای مشارکت کننده در پژوهش حاضر اخذ گردید.
حامی مالی
این مقاله برگرفته از پایاننامه کارشناسی ارشد خانم مینا گوزلی در گروه میکروبیولوژی، واحد اهر، دانشگاه آزاد اسلامی، اهر، ایران، با کد 22030507971004 است.
مشارکت نویسندگان
هر دو نویسنده سهمی برابر در اجرای پژوهش و نگارش مقاله حاضر داشتهاند.
تعارض منافع
در این مطالعه هیچگونه تضاد منافعی از سوی نویسندگان گزارش نشده است.
تشکر و قدردانی
بدینوسیله از تمامی کسانی که در این پژوهش ما را یاری کردند، تقدیر و تشکر به عمل میآید.
نتایج این بررسی نشان داد میزان بیان ژن NF-κB افزایش معنیداری در گروه بیمار دارد و ویروس اپشتینبار باعث کاهش بیان ژن NF-κB در لوسمی لنفوبلاستیک حاد شده است. لوسمی لنفوبلاستیک حاد (ALL) نوعی سرطان است که بر لنفوسیتها و سلولهای تولیدکننده لنفوسیت در مغز استخوان تأثیر میگذارد. لنفوسیتها نوعی از گلبولهای سفید خون هستند که آنتیبادی تولید کرده و از بخشهای حیاتی سیستم ایمنی بدن هستند. لنفوسیتها برای عملکرد خود به زیرگروههایی تقسیم میشوند که عمدهترین آنها سلولهای B و T هستند. در ALL، تجمعی از سلولهای تشکیلدهنده لنفوسیت نابالغ به نام سلولهای بلاست در مغز استخوان دیده میشود. این سلولها، سلولهای طبیعی خون را تحت تأثیر قرار داده و نهایتاً باعث کاهش تولید گلبولهای قرمز، گلبولهای سفید و پلاکتهای خون میشوند. لوسمی لنفوبلاستیک حاد (ALL) شایعترین بدخیمی در دوران کودکی است که در 80 الی 85 درصد موارد در کودکان کمتر از شش سال بروز میکند [17]. پوئی و همکاران نیز در مطالعه خود در سال 2004 بیان کردند که درگیری عصبی در بیماران مبتلا به لوسمی نادر است [18]. همچنین در مطالعه اکرمیپور و همکاران که به بررسی پنجساله کودکان مبتلا به لوسمی حاد میلوئیدی در بیمارستان شفای اهواز پرداخته بودند، به درگیری کمتر از 5/3 درصد سیستم عصبی در این بیماران اشاره شده است [19].
NF-κB یک فاکتور رونویسی است که نقش مهمی در التهاب، پاسخهای ایمنی، ایمنی ذاتی و اکتسابی با تنظیم جنبههای مختلف تکامل و عمل سلولهای عملگر ایفا مینماید که با مطالعه ما همخوانی دارد [20]. بررسیهای انجامشده در سال 2013 توسط نارایانان و همکاران روی سلولهای HepG کبدی نشان داد در سلولهای آلوده به ویروس2 گونههای فعال اکسیژن افزایش پیدا کرده و منجر به فعال کردن مسیر NF-κB در مراحل ابتدایی بیماری شده است که با مطالعه ما همخوانی دارد [21]. نتایج مطالعات چینی در سال 2001 نشان میدهد I3C و ترکیبات حاصل از آن از طریق مهار فاکتور رونویسی NF-κB میتواند باعث القای آپوپتوز در سلولهای سرطانی مختلف شود که با مطالعه ما همخوانی ندارد [22]. سالواتور و همکاران در سال 2005 در مطالعه خود بیان کردند به دنبال تیمار سلولها با دوکسوروبیسین، این ترکیب از طریق اتصال به DNA دورشتهای و پایداری کمپلکس آنزیم توپوایزومراز II، مانع سنتز DNA شده و این مسئله منجر به القای آپوپتوز میشود. از سوی دیگر، در کنار این فرایند مسیر دیگری نیز فعال میشود که با بهکارگیری NF-κB و به دنبال آن فعال شدن ژنهای دخیل در بقای سلولی مانند Survivin ،IAP1-c و XIAP از مرگ سلولی جلوگیری میکند که با مطالعه ما همخوانی دارد [23]. نتایج حاصل از مطالعه آدکوک و همکاران در سال 1997 نشان داد فعال شدن NF-κB نقش مهمی را در فرایندهای التهابی، پاسخهای ایمنی و مرگ سلولی به واسطه اتصال به پروموتر ژنهای مختلف مانند TNFα ،1β-IL و سیکلواکسیژناز 2 بازی میکند که با مطالعه ما همخوانی ندارد [24]. گو و همکاران در سال 2011 بیان کردند که والپروات با افزایش استیلاسیون NF-κB نورونها را از استرس اکسیداتیو القاکننده مرگ سلولی محافظت کرده و دارای اثر محافظ عصبی است که با مطالعه ما همخوانی دارد [25]. در بررسی روی پروتئینهای حد واسط، از ژنهای کاهش بیان یافته، 170 پروتئین کیناز مرتبط مشاهده شد که از این تعداد، 62 عدد، اختصاصی ژنهای دسته کاهش بیان یافته، پیشبینی شدند و از بین 62 عدد کیناز (Inhibitor of Nuclear Factor Kappa-B Kinase Subunit (Beta) IKBKB بهترین امتیاز را گرفت که نقش مهمی در مسیر سیگنالینگ NF-κB ایفا میکند و این مسیر در آسیبهای واردشده به DNA، التهاب سایتوکاینها، تولید باکتریها و ویروسها فعال شده و با فعال کردن صدها ژن باعث پاسخ ایمنی، کنترل رشد و محافظت در مقابل آپوپتوز میشود که با مطالعه ما همخوانی دارد [26]. روته و همکاران در مطالعه خود بیان کردند که برخی از مولکولهایی که بیان آنها در سلولهای آلوده به EBV تنظیم میشود ممکن است در فعالسازی NF-κB نقش غیرمستقیم ایفا کنند. طبق گزارشها سلولهای SNK6 TNF-α را تولید میکنند که NF-κB را در سلولهای T و NK فعال میکند [27]. روته و همکاران در سال 1995 در مطالعات خود بیان کردند که NF-κB میتواند در پاییندست از CD40 و CD137 فعال شود. بیان CD40 یا CD137 ناشی از EBV ممکن است در فعالسازی NF-κB در سلولهای EBV-T / NK نقش داشته باشد که با مطالعه ما همخوانی ندارد [27]. سوگانو و همکاران در سال 1997 بیان کردند اتصال EBV فعالسازی NF-κB را آغاز میکند که برای عفونت موفقیتآمیز سلول لازم است. فعالیت NF-κB به نوبه خود، همچنین بیان مولکول CD21 را تنظیم میکند که ممکن است یک حلقه بازخورد مثبت برای تقویت حساسیت سلول به ورود EBV فراهم کند که با مطالعه ما همخوانی ندارد [28]. کاهیر مکفارلند و همکاران در سال 2004 در مطالعهای نشان دادند حذف فعالیت NF-κB باعث بروز آپوپتوز ردههای سلولی لنفوم آلوده به EBV در شرایط آزمایشگاهی و موش میشود و نشان میدهد که این یک مسیر اساسی است که توسط انکوپروتئینهای ویروسی ایجاد میشود که با مطالعه ما همخوانی دارد [29]. بین فعالسازی NF-κB و تکثیر سلولی در بازداشت چرخه سلولی رابطه وجود دارد. بر اساس تعادل نسبی بین عملکردهای بیولوژیکی و بیوشیمیایی NF-κB، همچنین نقش مهم NF-κB در مقاومت به آپوپتوز و کنترل تقسیم سلولهای بنیادی خونساز، اخیراً به خوبی مشخص شده است که NF-κB نیز در استرس اکسیداتیو نقش دارد. فعالسازی NF-κB مسئول فعال شدن اکسید نیتریک اکساید سنتاز (iNOS) برای افزایش اکسید نیتریک (NO) است که به عنوان یک عملکرد طرفدار آپوپتوز NF-κB توصیف شده است. الگوی تولید NO ممکن است بقای سلولی را کنترل کند، زیرا مشخص شد که تولید حاد NO باعث آپوپتوز میشود. اما از طرف دیگر، تولید مزمن NO با سیگنالینگ NF-κB سازنده فعال میتواند مکانیسم آپوپتوز را مهار کند که با مطالعه ما همخوانی دارد [30]. صفا و همکاران درسال 2015 در مطالعهای بیان کردند که در تومورزایی انسان، NF-κB یک عامل مهم در بقای سلولهای سرطانی است که با مطالعه ما همخوانی دارد [31]. پوگلیو و همکاران در سال 2015 در مطالعهای بیان کردند تغییرات در مسیر NF-κB بهویژه در ALL و سایر لوسمیها به رسمیت شناخته شده است؛ به عنوان مثال، تنظیم آن باید آپوپتوز سلولهای لوسمی را تسهیل کند که با مطالعه ما همخوانی دارد [32]. در یک مطالعه منتشرشده از لتینن و همکاران در سال 2003 نشان داده شد فعال شدن مجدد مادر از عفونت EBV در سهماهه اول با افزایش قابل توجهی در بروز ALL در فرزندان همراه است که با مطالعه ما همخوانی ندارد [15]. تاکادا و همکاران در سال 2005 نشان دادند آپوپتوز ناشی از TNF را از طریق سرکوب NF-κB در لوسمی سلول حاد انسانی سلول جورکات تقویت میکند که با مطالعه ما همخوانی دارد [14].
نتیجهگیری
ژن NF-κB میتواند به عنوان یک پیشآگهی تشخیص لوسمی لنفوبلاستیک حاد باشدکه نیاز به مطالعات بیشتر در این زمینه است. همچنین انجام مطالعات بیشتر در مورد عفونت EBV و بیماری لنفوبلاستیک حاد ضروری است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
رضایت آگاهانه از بیماران و خانوادههای مشارکت کننده در پژوهش حاضر اخذ گردید.
حامی مالی
این مقاله برگرفته از پایاننامه کارشناسی ارشد خانم مینا گوزلی در گروه میکروبیولوژی، واحد اهر، دانشگاه آزاد اسلامی، اهر، ایران، با کد 22030507971004 است.
مشارکت نویسندگان
هر دو نویسنده سهمی برابر در اجرای پژوهش و نگارش مقاله حاضر داشتهاند.
تعارض منافع
در این مطالعه هیچگونه تضاد منافعی از سوی نویسندگان گزارش نشده است.
تشکر و قدردانی
بدینوسیله از تمامی کسانی که در این پژوهش ما را یاری کردند، تقدیر و تشکر به عمل میآید.
References
1.Kliegman R, Stanton B, Geme JSt, Schor NF. Nelson Textbook of Pediatrics. 20th ed. Amsterdam: Elsevier; 2016.
2.Lanzkowsky Ph. Manual of pediatric hematology and oncology. 5th ed. Amsterdam: Elsevier; 2010.
3.Ahmed HG, Osman SI, Ashankyty IM. Incidence of epstein-barr virus in pediatric leukemia in the Sudan. Clinical Lymphoma, Myeloma & Leukemia. 201SSS2; 12(2):127-31. [DOI:10.1016/j.clml.2011.11.006] [PMID]
4.Bogdanovic G, Jernberg AG, Priftakis P, Grillner L, Gustafsson B. Human herpes virus 6 or epstein-barr virus were not detected in guthrie cards from children who later developed leukaemia. British Journal of Cancer. 2004; 91:913-5. [DOI:10.1038/sj.bjc.6602099]
5.Borges E, Ferry JA, Friedmann AM. Epstein-barr virus-negative precursor B cell lymphoblastic lymphoma after liver transplantation: A unique form of posttransplant lymphoproliferative disease. Transplantation. 2002; 73(4):541-3. [DOI:10.1097/00007890-200202270-00008] [PMID]
6.Szymula A. Genetic analysis of the role of Epstein-Barr Virus Nuclear Antigen Leader Protein (EBNA-LP) in B cell transformation. [PhD. Dissertation]. London. Imperial College London; 2016. [DOI:10.25560/44554] https://ethos.bl.uk/OrderDetails.do?uin=uk.bl.ethos.705836
7.Fasan O, Willmott C, Czepulkowski B, Baker A, Rees D, Salisbury J, et al. Epstein-barr virus-related post-transplant lymphoproliferative disorder with t(9;14)(p11-12;q32). Cancer Genet Cytogenet. 2003; 142(2):134-6. [DOI:10.1016/s0165-4608(02)00838-5] [PMID]
8.Huang J, Chen H, Hutt-Fletcher L, Ambinder RF, Hayward SD. Lytic viral replication as a contributor to the detection of epstein-barr virus in breast cancer. Journal Virology. 2003; 77(24):13267-74. [DOI:10.1128/jvi.77.24.13267-13274.2003] [PMID] [PMCID]
9.Kawabata Y, Hirokawa M, Saitoh Y, Kosugi S, Yoshioka T, Fujishima M, et al. Late-onset fatal epstein-barr virus-associated hemophagocytic syndrome following cord blood cell transplantation for adult acute lymphoblastic leukemia. International Journal of Hematology. 2006; 84(5):445-8. [DOI:10.1532/IJH97.06101] [PMID]
10.Levine RL. Inherited susceptibility to pediatric acute lymphoblastic leukemia. Nature Genetics. 2009; 41(9):957-8. [DOI:10.1038/ng0909-957] [PMID]
11.Woods JA, Vieira VJ, Keylock KT. Exercise, inflammation, and innate immunity. Immunology & Allergy Clinics of North America. 2009; 29(2):381-93. [DOI:10.1016/j.iac.2009.02.011] [PMID]
12.Mattson MP, Camandola S. NF-kappaB in neuronal plasticity and neurodegenerative disorders. Journal Clinical Investigation. 2001; 107(3):247-54. [DOI:10.1172/JCI11916] [PMID] [PMCID]
13.Culver C, Sundqvist A, Mudie S, Melvin A, Xirodimas D, Rocha S. Mechanism of hypoxia-induced NF-kappaB. Molecular and Celluler Biology Biol. 2010; 30(20):4901-21. [DOI:10.1128/MCB.00409-10] [PMID] [PMCID]
14.Takada Y, Andreeff M, Aggarwal BB. Indole-3-carbinol suppresses NF-kappaB and IkappaBalpha kinase activation, causing inhibition of expression of NF-kappaB-regulated antiapoptotic and metastatic gene products and enhancement of apoptosis in myeloid and leukemia cells. Blood. 2005; 106(2):641-9. [DOI:10.1182/blood-2004-12-4589] [PMID] [PMCID]
15.Lehtinen M, Koskela P, Ogmundsdottir HM, Bloigu A, Dillner J, Gudnadottir M, et al. Maternal herpesvirus infections and risk of acute lymphoblastic leukemia in the offspring. American Journal of Epidemiology. 2003; 158(3):207-13. [DOI:10.1093/aje/kwg137] [PMID]
16.Rojkind M, Domínguez-Rosales JA, Nieto N, Greenwel P. Role of hydrogen peroxide and oxidative stress in healing responses. Cellular and Molecular Life Sciences. 2002; 59(11):1872-91. [DOI:10.1007/pl00012511] [PMID]
17.Mitrus AJ, Rosenthal DS. Adult leukemias. In: Holleb AI, Fink DJ, Murphy GP, editors. American society textbook of clinical oncology. Atlanta: The American Cancer Society; 1991.
18.Pui CH, Relling MV, Downing JR. Acute lymphoblastic leukemia. New England Journal of Medicine. 2004; 350(15):1535-48. [DOI:10.1056/NEJMra023001] [PMID]
19.Akramipour R, Pedram M, Zandian K, Hashemi A. [A 5-Year- study on Children with Acute Myelocytic Leukemia/AML, Ahvaz Shafa Hospital (1996-2001) (Persian)]. Journal of Kermanshah University of Medical Sciences. 2007;11(2):e80674. https://sites.kowsarpub.com/jkums/articles/80674.html
20.Shih VF, Tsui R, Caldwell A, Hoffmann A. A single NFκB system for both canonical and non-canonical signaling. Cell Research. 2011; 21(1):86-102. [DOI:10.1038/cr.2010.161] [PMID] [PMCID]
21.Narayanan A, Amaya M, Voss K, Chung M, Benedict A, Sampey G, et al. Reactive oxygen species activate NFκB (p65) and p53 and induce apoptosis in RVFV infected liver cells. Virology. 2014; 449:270-86. [DOI:10.1016/j.virol.2013.11.023] [PMID]
22.Chinni SR, Li Y, Upadhyay S, Koppolu PK, Sarkar FH. Indole-3-carbinol (I3C) induced cell growth inhibition, G1 cell cycle arrest and apoptosis in prostate cancer cells. Oncogene. 2001; 20(23):2927-36. [DOI:10.1038/sj.onc.1204365] [PMID]
23.Salvatore C, Camarda G, Maggi CA, Goso C, Manzini S, Binaschi M. NF-kappaB activation contributes to anthracycline resistance pathway in human ovarian carcinoma cell line A2780. International Journal of Oncology. 2005; 27(3):799-806. [PMID]
24.Adcock IM. Transcription factors as activators of gene transcription: AP-1 and NF-kappa B. Monaldi Archives for Chest Disease. 1997; 52(2):178-86. [PMID]
25.Go HS, Seo JE, Kim KC, Han SM, Kim P, Kang YS, et al. Valproic acid inhibits neural progenitor cell death by activation of NF-κB signaling pathway and up-regulation of Bcl-XL. Journal of Biomedical Science. 2011; 18(1):48. [DOI:10.1186/1423-0127-18-48] [PMID] [PMCID]
26.Salmerón A, Janzen J, Soneji Y, Bump N, Kamens J, Allen H, et al. Direct phosphorylation of NF-kappaB1 p105 by the IkappaB kinase complex on serine 927 is essential for signal-induced p105 proteolysis. Journal of Biological Chemistry. 2001; 276(25):22215-22. [DOI:10.1074/jbc.M101754200] [PMID]
27.Rothe M, Sarma V, Dixit VM, Goeddel DV. TRAF2-mediated activation of NF-kappa B by TNF receptor 2 and CD40. Science. 1995; 269(5229):1424-7. [DOI:10.1126/science.7544915] [PMID]
28.Sugano N, Chen W, Roberts ML, Cooper NR. Epstein-barr virus binding to CD21 activates the initial viral promoter via NF-kappaB induction. Journal of Experimental Medicine. 1997; 186(5):731-7. [DOI:10.1084/jem.186.5.731] [PMID] [PMCID]
29.Cahir-McFarland ED, Carter K, Rosenwald A, Giltnane JM, Henrickson SE, Staudt LM, et al. Role of NF-kappa B in cell survival and transcription of latent membrane protein 1-expressing or Epstein-barr virus latency III-infected cells. Journal of Virology. 2004; 78(8):4108-19. [DOI:10.1128/jvi.78.8.4108-4119.2004] [PMID] [PMCID]
30.Li Q, Verma IM. NF-kappaB regulation in the immune system. Nature Reviews Immunology. 2002; 2(10):725-34. [DOI:10.1038/nri910] [PMID]
31.Safa M, Tavasoli B, Manafi R, Kiani F, Kashiri M, Ebrahimi S, et al. [Indole-3-carbinol suppresses NF-κB activity and stimulates the p53 pathway in pre-B acute lymphoblastic leukemia cells (Persian)]. Tumour Biology. 2015; 36(5):3919-30. [DOI:10.1007/s13277-014-3035-1] [PMID]
32.Poglio S, Cahu X, Uzan B, Besnard-Guérin C, Lapillonne H, Leblanc T, et al. Rapid childhood T-aLL growth in xenograft models correlates with mature phenotype and NF-κB pathway activation but not with poor prognosis. Leukemia. 2015; 29(4):977-80. [DOI:10.1038/leu.2014.317] [PMID]
نوع مطالعه: پژوهشی |
موضوع مقاله:
علوم پايه پزشكي
دریافت: 1399/9/1 | پذیرش: 1399/12/9 | انتشار: 1400/7/9
دریافت: 1399/9/1 | پذیرش: 1399/12/9 | انتشار: 1400/7/9
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






.jpg)
.jpg)
.jpg)