

دوره 28، شماره 1 - ( زمستان 1400 )
جلد 28 شماره 1 صفحات 127-98 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Malekzadeh A, Zare A, Yaghoubi M, Alizadehsani R. A Method for Epileptic Seizure Detection in EEG Signals Based on Tunable Q-Factor Wavelet Transform Method Using Grasshopper Optimization Algorithm With Support Vector Machine Classifier. Intern Med Today 2021; 28 (1) :98-127
URL: http://imtj.gmu.ac.ir/article-1-3796-fa.html
URL: http://imtj.gmu.ac.ir/article-1-3796-fa.html
ملک زاده انیس، زارع آصف، یعقوبی مهدی، علیزاده ثانی روح الله. تشخیص تشنج صرع در سیگنالهای EEG با استفاده از طبقهبندی TQWT و SVM-GOA. طب داخلی روز. 1400; 28 (1) :98-127
انیس ملک زاده1 

 ، آصف زارع*2
، آصف زارع*2 

 ، مهدی یعقوبی3
، مهدی یعقوبی3 

 ، روح الله علیزاده ثانی4
، روح الله علیزاده ثانی4 




 ، آصف زارع*2
، آصف زارع*2 

 ، مهدی یعقوبی3
، مهدی یعقوبی3 

 ، روح الله علیزاده ثانی4
، روح الله علیزاده ثانی4 


1- گروه مهندسی برق، دانشکده مهندسی برق، واحد گناباد، دانشگاه آزاد اسلامی، گناباد، ایران.
2- گروه مهندسی برق، دانشکده مهندسی برق، واحد گناباد، دانشگاه آزاد اسلامی، گناباد، ایران. ،assefzare@gmail.com
3- گروه مهندسی برق، دانشکده مهندسی، واحد مشهد، دانشگاه آزاد اسلامی، مشهد، ایران.
4- مؤسسه تحقیقات و نوآوری سیستمهای هوشمند (IISRI)، دانشگاه دیکین، جیلونگ، استرالیا.
2- گروه مهندسی برق، دانشکده مهندسی برق، واحد گناباد، دانشگاه آزاد اسلامی، گناباد، ایران. ،
3- گروه مهندسی برق، دانشکده مهندسی، واحد مشهد، دانشگاه آزاد اسلامی، مشهد، ایران.
4- مؤسسه تحقیقات و نوآوری سیستمهای هوشمند (IISRI)، دانشگاه دیکین، جیلونگ، استرالیا.
متن کامل [PDF 8937 kb]
(2076 دریافت)
| چکیده (HTML) (5675 مشاهده)
References
1.Shoeibi A, Khodatars M, Ghassemi N, Jafari M, Moridian P, Alizadehsani R, et al. Epileptic seizures detection using deep learning techniques: A review. International Journal of Environmental Research and Public Health. 2021; 18(11):5780. [DOI:10.3390/ijerph18115780] [PMID] [PMCID]
2.Shoeibi A, Ghassemi N, Khodatars M, Jafari M, Moridian P, Alizadehsani R, et al. Applications of epileptic seizures detection in neuroimaging modalities using deep learning techniques: Methods, challenges, and future works. arXiv preprint arXiv:2105.14278. 2021. https://arxiv.org/pdf/2105.14278.pdf
3.Subasi A. Epileptic seizure detection using dynamic wavelet network. Expert Systems with Applications. 2005; 29(2):343-55. [DOI:10.1016/j.eswa.2005.04.007]
4.Subasi A, Erçelebi E, Alkan A, Koklukaya E. Comparison of subspace-based methods with AR parametric methods in epileptic seizure detection. Computers in Biology and Medicine. 2006; 36(2):195-208. [DOI:10.1016/j.compbiomed.2004.11.001] [PMID]
5.Alizadehsani R, Roshanzamir M, Hussain S, Khosravi A, Koohestani A, Zangooei MH, et al. Handling of uncertainty in medical data using machine learning and probability theory techniques: A review of 30 years (1991–2020). Annals of Operations Research. 2021:1-42. [DOI:10.1007/s10479-021-04006-2] [PMID] [PMCID]
6.Siddiqui MK, Morales-Menendez R, Huang X, Hussain N. A review of epileptic seizure detection using machine learning classifiers. Brain Informatics. 2020; 7(1):5. [DOI:10.1186/s40708-020-00105-1] [PMID] [PMCID]
7.Piccialli F, Di Somma V, Giampaolo F, Cuomo S, Fortino G. A survey on deep learning in medicine: Why, how and when? Information Fusion. 2021; 66:111-37. [DOI:10.1016/j.inffus.2020.09.006]
8.Akay A, Hess H. Deep learning: Current and emerging applications in medicine and technology. IEEE Journal of Biomedical and Health Informatics. 2019; 23(3):906-20. [DOI:10.1109/JBHI.2019.2894713] [PMID]
9.Srinivasan V, Eswaran C, Sriraam N. Artificial neural network based epileptic detection using time-domain and frequency-domain features. Journal of Medical Systems. 2005; 29(6):647-60. [DOI:10.1007/s10916-005-6133-1] [PMID]
10.Faust O, Acharya UR, Min LC, Sputh BH. Automatic identification of epileptic and background EEG signals using frequency domain parameters. International Journal of Neural Systems. 2010; 20(2):159-76. [DOI:10.1142/S0129065710002334] [PMID]
11.Li M, Sun X, Chen W, Jiang Y, Zhang T. Classification epileptic seizures in EEG using time-frequency image and block texture features. IEEE Access. 2019; 8:9770-81. [DOI:10.1109/ACCESS.2019.2960848]
12.Yuan Q, Zhou W, Liu Y, Wang J. Epileptic seizure detection with linear and nonlinear features. Epilepsy & Behavior. 2012; 24(4):415-21. [DOI:10.1016/j.yebeh.2012.05.009] [PMID]
13.Goodfellow I, Bengio Y, Courville A. Deep learning. United States: MIT press; 2016. https://books.google.com/books/about/Deep_Learning.html?id=Np9SDQAAQBAJ
14.Emami A, Kunii N, Matsuo T, Shinozaki T, Kawai K, Takahashi H. Autoencoding of long-term scalp electroencephalogram to detect epileptic seizure for diagnosis support system. Computers in Biology and Medicine. 2019; 110:227-33. [DOI:10.1016/j.compbiomed.2019.05.025] [PMID]
15.Jaafar ST, Mohammadi M. Epileptic seizure detection using deep learning approach. UHD Journal of Science and Technology. 2019; 3(2):41-50. [DOI:10.21928/uhdjst.v3n2y2019.pp41-50]
16.Shahbazi M, Aghajan H. A generalizable model for seizure prediction based on deep learning using CNN-LSTM architecture. IEEE Global Conference on Signal and Information Processing (GlobalSIP), 2018 Nov 26, Anaheim, CA, USA. [DOI:10.1109/GlobalSIP.2018.8646505]
17.Truong ND, Kavehei O. Low precision electroencephalogram for seizure detection with convolutional neural network. IEEE International Conference on Artificial Intelligence Circuits and Systems (AICAS), 2019 Mar 18, Taiwan. [DOI:10.1109/AICAS.2019.8771569]
18.Zhou M, Tian C, Cao R, Wang B, Niu Y, Hu T, et al. Epileptic seizure detection based on EEG signals and CNN. Frontiers in Neuroinformatics. 2018; 12:95. [DOI:10.3389/fninf.2018.00095] [PMID] [PMCID]
19.Movahedi F, Coyle JL, Sejdić E. Deep belief networks for electroencephalography: A review of recent contributions and future outlooks. IEEE Journal of Biomedical and Health Informatics. 2017; 22(3):642-52. [DOI:10.1109/JBHI.2017.2727218] [PMID] [PMCID]
20.Selesnick IW. Wavelet transform with tunable Q-factor. IEEE Transactions on Signal Processing. 2011; 59(8):3560-75. [DOI:10.1109/TSP.2011.2143711]
21.Abualigah L, Diabat A. A comprehensive survey of the Grasshopper optimization algorithm: Results, variants, and applications. Neural Computing and Applications. 2020; 32(19):15533-56. [DOI:10.1007/s00521-020-04789-8].
22.Department of Epileptology University of Bonn. EEG time series data. Bonn: Department of Epileptology University of Bonn, Germany; 2015. http://epileptologie-bonn.de/cms/front_content.php?idcat=193&lang=3&changelang=3 [accessed September, 2015]
23.Sameer M, Gupta B. Detection of epileptical seizures based on alpha band statistical features. Wireless Personal Communications. 2020; 115(2):909-25. [DOI:10.1007/s11277-020-07852-8]
24.Esteller R, Vachtsevanos G, Echauz J, Litt B. A comparison of waveform fractal dimension algorithms. IEEE Transactions on Circuits and Systems I: Fundamental Theory and Applications. 2001; 48(2):177-83. [DOI:10.1109/81.904882]
25.Madan S, Srivastava K, Sharmila A, Mahalakshmi P. A case study on Discrete Wavelet Transform based Hurst exponent for epilepsy detection. Journal of Medical Engineering & Technology. 2018; 42(1):9-17. [DOI:10.1080/03091902.2017.1394390] [PMID]
26.Acharya UR, Hagiwara Y, Koh JE, Oh SL, Tan JH, Adam M, et al. Entropies for automated detection of coronary artery disease using ECG signals: A review. Biocybernetics and Biomedical Engineering. 2018; 38(2):373-84. [DOI:10.1016/j.bbe.2018.03.001]
27.Mohammadpoory Z, Nasrolahzadeh M, Haddadnia J. Epileptic seizure detection in EEGs signals based on the weighted visibility graph entropy. Seizure. 2017; 50:202-8. [DOI:10.1016/j.seizure.2017.07.001] [PMID]
28.Wang Y, Yao H, Zhao S. Auto-encoder based dimensionality reduction. Neurocomputing. 2016; 184:232-42. [DOI:10.1016/j.neucom.2015.08.104]
29.William SN, Teukolsky SA. What is a support vector machine. Nat Biotechnol. 2006; 24(12):1565-7. [DOI:10.1038/nbt1206-1565] [PMID]
30.Keller JM, Gray MR, Givens JA. A fuzzy k-nearest neighbor algorithm. IEEE Transactions on Systems, Man, and Cybernetics. 1985; 15(4):258-63. [DOI:10.1109/TSMC.1985.6313426]
31.Oshiro TM, Perez PS, Baranauskas JA. How many trees in a random forest? International workshop on machine learning and data mining in pattern recognition. Berlin, Heidelberg: Springer; 2012. [DOI:10.1007/978-3-642-31537-4_13]
32.Ketkar N. Introduction to GPUs. Deep learning with Python. 1th ed. Berkeley, CA: Apress; 2017. [DOI:10.1007/978-1-4842-2766-4_10]
33.Pedregosa F, Varoquaux G, Gramfort A, Michel V, Thirion B, Grisel O, et al. Scikit-learn: Machine learning in Python. The Journal of Machine Learning Research. 2011; 12:2825-30. https://www.jmlr.org/papers/volume12/pedregosa11a/pedregosa11a.pdf?ref=https://githubhelp.com
34.Ghassemi N, Shoeibi A, Rouhani M, Hosseini-Nejad H. Epileptic seizures detection in EEG signals using TQWT and ensemble learning. 9th International Conference on Computer and Knowledge Engineering (ICCKE), 2019 Oct 24, Mashhad, Iran. [DOI:10.1109/ICCKE48569.2019.8964826]
35.Nishad A, Pachori RB. Classification of epileptic electroencephalogram signals using tunable-Q wavelet transform based filter-bank. Journal of Ambient Intelligence and Humanized Computing. 2020. [DOI:10.1007/s12652-020-01722-8]
36.Sharaf AI, El-Soud MA, El-Henawy IM. An automated approach for epilepsy detection based on tunable Q-wavelet and firefly feature selection algorithm. International Journal of Biomedical Imaging. 2018; 2018:5812872. [DOI:10.1155/2018/5812872] [PMID] [PMCID]
37.Gupta V, Bhattacharyya A, Pachori RB. Classification of seizure and non-seizure EEG signals based on EMD-TQWT method. 22nd International Conference on Digital Signal Processing (DSP), 2017 Aug 23, London, United Kingdom. [DOI:10.1109/ICDSP.2017.8096036]
38.Reddy GR, Rao R. Automated identification system for seizure EEG signals using tunable-Q wavelet transform. Engineering Science and Technology, an International Journal. 2017; 20(5):1486-93. [DOI:10.1016/j.jestch.2017.11.003]
39.Ramos-Aguilar R, Olvera-López JA, Olmos-Pineda I, Sánchez-Urrieta S. Feature extraction from EEG spectrograms for epileptic seizure detection. Pattern Recognition Letters. 2020; 133:202-9. [DOI:10.1016/j.patrec.2020.03.006]
40.Chen S, Zhang X, Chen L, Yang Z. Automatic diagnosis of epileptic seizure in electroencephalography signals using nonlinear dynamics features. IEEE Access. 2019; 7:61046-56. [DOI:10.1109/ACCESS.2019.2915610]
41.Tuncer T, Dogan S, Akbal E. A novel local senary pattern based epilepsy diagnosis system using EEG signals. Australasian Physical & Engineering Sciences in Medicine. 2019; 42(4):939-48. [DOI:10.1007/s13246-019-00794-x] [PMID]
42.Gupta V, Pachori RB. Epileptic seizure identification using entropy of FBSE based EEG rhythms. Biomedical Signal Processing and Control. 2019; 53:101569. [DOI:10.1016/j.bspc.2019.101569]
43.Raghu S, Sriraam N, Hegde AS, Kubben PL. A novel approach for classification of epileptic seizures using matrix determinant. Expert Systems with Applications. 2019; 127:323-41. [DOI:10.1016/j.eswa.2019.03.021]
44.Sharma S, Bhatia V, Gupta A. Noncoherent IR-UWB receiver using massive antenna arrays for wireless sensor networks. IEEE Sensors Letters. 2017; 2(1):1-4. [DOI:10.1109/LSENS.2017.2778430]
45.Abedin MZ, Akther S, Hossain MS. An artificial neural network model for epilepsy seizure detection. 5th International Conference on Advances in Electrical Engineering (ICAEE) 2019 Sep 26, Dhaka, Bangladesh. [DOI:10.1109/ICAEE48663.2019.8975569]
46.Tzimourta KD, Tzallas AT, Giannakeas N, Astrakas LG, Tsalikakis DG, Angelidis P, et al. A robust methodology for classification of epileptic seizures in EEG signals. Health and Technology. 2019; 9(2):135-42. [DOI:10.1007/s12553-018-0265-z]
47.Singh G, Kaur M, Singh B. Detection of epileptic seizure EEG signal using multiscale entropies and complete ensemble empirical mode decomposition. Wireless Personal Communications. 2021; 116(1):845-64. [DOI:10.1007/s11277-020-07742-z]
48.Liu Y, Jiang B, Feng J, Hu J, Zhang H. Classification of EEG signals for epileptic seizures using feature dimension reduction algorithm based on LPP. Multimedia Tools and Applications. 2021; 80(20):30261-82. [DOI:10.1007/s11042-020-09135-7]
49.Aliyu I, Lim CG. Selection of optimal wavelet features for epileptic EEG signal classification with LSTM. Neural Computing and Applications. 2021. [DOI:10.1007/s00521-020-05666-0]
50.Sameer M, Gupta B. Beta band as a biomarker for classification between interictal and ictal states of epileptical patients. 7th International Conference on Signal Processing and Integrated Networks (SPIN), 2020 Feb 27, Noida, India. [DOI:10.1109/SPIN48934.2020.9071343]
51.Qureshi MB, Afzaal M, Qureshi MS, Fayaz M. Machine learning-based EEG signals classification model for epileptic seizure detection. Multimedia Tools and Applications. 2021; 80(12):17849-77. [DOI:10.1007/s11042-021-10597-6]
52.Al-Hadeethi H, Abdulla S, Diykh M, Deo RC, Green JH. Adaptive boost LS-SVM classification approach for time-series signal classification in epileptic seizure diagnosis applications. Expert Systems with Applications. 2020; 161:113676. [DOI:10.1016/j.eswa.2020.113676
53.Whitley D. A genetic algorithm tutorial. Statistics and Computing. 1994; 4(2):65-85. [DOI:10.1007/BF00175354]
54.Zhou C, Gao HB, Gao L, Zhang WG. Particle swarm optimization (PSO)algorithm. Application Research of Computers. 2003; 12:7-11
55.Settles M, Soule T. Breeding swarms: A GA/PSO hybrid. 7th annual conference on genetic and evolutionary computation, 2005 Jun 25, New York, United States. [DOI:10.1145/1068009.1068035
56.Khodatars M, Shoeibi A, Sadeghi D, Ghassemi N, Jafari M, Moridian P, et al. Deep learning for neuroimaging-based diagnosis and rehabilitation of autism spectrum disorder: A review. Computers in Biology and Medicine. 2021; 139:104949 [DOI:10.1016/j.compbiomed.2021.104949] [PMID]
57.Shoeibi A, Sadeghi D, Moridian P, Ghassemi N, Heras J, Alizadehsani R, et al. Automatic diagnosis of schizophrenia using EEG signals and CNN-LSTM models. Frontiers in Neuroinformatics. 2021; 15:777977 [DOI:10.3389/fninf.2021.777977] [PMID] [PMCID]
58.Shoeibi A, Khodatars M, Jafari M, Moridian P, Rezaei M, Alizadehsani R, et al. Applications of deep learning techniques for automated multiple sclerosis detection using magnetic resonance imaging: A review. Computers in Biology and Medicine. 2021; 136:104697. [DOI:10.1016/j.compbiomed.2021.104697] [PMID]
59.Sadeghi D, Shoeibi A, Ghassemi N, Moridian P, Khadem A, Alizadehsani R, et al. An overview on artificial intelligence techniques for diagnosis of schizophrenia based on magnetic resonance imaging modalities: Methods, challenges, and future works. arXiv preprint arXiv:2103.03081. 2021. https://arxiv.org/abs/2103.03081
60.Alizadehsani R, Sharifrazi D, Izadi NH, Joloudari JH, Shoeibi A, Gorriz JM, et al. Uncertainty-aware semi-supervised method using large unlabeled and limited labeled COVID-19 data. ACM Transactions on Multimedia Computing, Communications, and Applications. 2021; 17(3s):1-24. [DOI:10.1145/3462635]
61.Yang J, Yao S, Wang J. Deep fusion feature learning network for MI-EEG classification. IEEE Access. 2018; 6:79050-9. [DOI:10.1109/ACCESS.2018.2877452]
62.Amin SU, Alsulaiman M, Muhammad G, Mekhtiche MA, Hossain MS. Deep Learning for EEG motor imagery classification based on multi-layer CNNs feature fusion. Future Generation Computer Systems. 2019; 101:542-54. [DOI:10.1016/j.future.2019.06.027]
63.Hu D, Cao J, Lai X, Wang Y, Wang S, Ding Y. Epileptic state classification by fusing hand-crafted and deep learning EEG features. IEEE Transactions on Circuits and Systems II: Express Briefs. 2020; 68(4):1542-6. [DOI:10.1109/TCSII.2020.3031399]
متن کامل: (6536 مشاهده)
مقدمه
صرع یک خطر عصبی مزمن غیر قابل انتقال است که ممکن است بر روی افراد در هر سنی تأثیر بگذارد [1]. ممکن است از آن به عنوان یک بیماری شایع مغزی یاد شود. تقریباً 50 میلیون نفر در سراسر جهان به شکل اغراقآمیزی به آن مبتلا هستند. 80 درصد مبتلایان به این بیماری در کشورهای متوسط و کمدرآمد زندگی میکنند. در صورت درمان و تشخیص مناسب، 70 درصد از افراد مبتلا به این بیماری میتوانند به زندگی بدون تشنج برسند. خطر مرگ زودرس در افراد مبتلا به صرع 3 برابر بیشتر از افراد عادی است. سهچهارم بیماران صرعی که در کشورهای در حال توسعه زندگی میکنند، نمیتوانند به درمان لازم بپردازند [2]. چنین بیمارانی و خانوادههایشان از تبعیض و انگ رنج میبرند. صرع دو نوع عمومی و کانونی دارد [3]. اثرات صرع کانونی بر روی ناحیهای از مغز است و پیدا کردن بخشی از مغز که تحت تأثیر صرع کانونی قرار گرفته است برای مراقبتهای پزشکی مهم است. شصت درصد بیماران صرع کانونی و بیست درصد بیماران مبتلا به صرع عمومی به دارو مقاوم میشوند و برای چنین بیمارانی نیاز به عمل جراحی است [4].
روشهای مختلفی برای تشخیص تشنج صرع ارائه شده است، از جمله روشهای بالینی و روشهای تصویربرداری عصبی [2 ،1] که در میان آنها روشهای تصویربرداری عصبی به طور گسترده توسط پزشکان استفاده میشود [2 ،1]. به طور کلی، روشهای تصویربرداری عصبی به روشهای عملکردی و ساختاری طبقهبندی میشوند [1 ,2, 3] و ثبت سیگنالهای الکتروانسفالوگرافی یک روش تشخیص تشنج صرع بر اساس روشهای تصویربرداری عصبی عملکردی است [2 ،1]. سیگنالهای الکتروانسفالوگرافی اطلاعات ضروری را از محل تشنج صرع ارائه میدهند که به پزشکان کمک میکند تا تشنجهای صرعی را با دقت بالاتر تشخیص دهند [1 ,2, 3].
تشخیص تشنجهای صرع از طریق سیگنالهای الکتروانسفالوگرافی کاری چالشبرانگیز برای پزشکان متخصص است [2 ،1]. سیگنالهای الکتروانسفالوگرافی با پیچیدگی نسبتاً زیادی همراه هستند و برای تشخیص صحیح، چالش و دشواری ایجاد میکنند [2 ،1]. بر این اساس، با استفاده از روش هوش مصنوعی، هدف محققان تشخیص زودهنگام تشنجهای صرع از طریق سیگنالهای الکتروانسفالوگرافی است. تشنجهای صرع با استفاده از یادگیری ماشینی [4 ,5, 6] و یادگیری عمیق [7, 8] انجام میشوند که از جمله تکنیکهای هوش مصنوعی هستند.
در CADS مبتنی بر ML، تکنیکهای استخراج ویژگی شامل زمان، فرکانس، زمان ـ فرکانس و روشهای غیرخطی [9, 10, 11, 12] است. همچنین در CADS مبتنی بر روشهای DL تکنیکهای تشخیص تشنجهای صرع، رمزنگارهای خودکار، شبکههای عصبی بازگشتی، شبکههای عصبی کانولوشن و شبکههای باور عمیق هستند [13, 14, 15, 16, 17, 18, 19].
عابدین و همکاران [45] یک روش تشخیص تشنج صرع را بر اساس ویژگیهای آماری ارائه کردند و به نتایج امیدوارکنندهای دست یافتند. این مطالعه ابتدا از یک مجموعه داده بن و روش تبدیل موجک گسسته برای پیشپردازش و تجزیهوتحلیل سیگنالهای الکتروانسفالوگرافی به زیرباندهای مختلف استفاده کرد. سپس، هر زیرباند DWT برای استخراج برخی از ویژگیهای آماری مورد بررسی قرار گرفت و شبکه عصبی مصنوعی برای طبقهبندی دادهها استفاده شد. سینگ و همکاران [47] روش جدیدی برای تشخیص تشنج صرع از سیگنالهای الکتروانسفالوگرافی مجموعه داده بن پیشنهاد کردند. آنها از روشهای تجزیهی مد تجربی یکپارچه کامل، یعنی تجزیه مجموعههای تکمیلی حالت تجربی و آنتروپی پراکندگی چند مقیاس تصفیهشده برای انجام پیش پردازش و استخراج خواص استفاده کردند و روشهای مختلفی را برای انتخاب ویژگی آزمایش کردند تا اندازه ماتریس ویژگی را کاهش دهند. درنهایت، تکنیک طبقهبندی شبکه عصبی مصنوعی استفاده شد و به نتایج امیدوارکنندهای منجر شد. علیو و همکاران [49] یک تشخیص تشنج صرع را بر اساس انتخاب تبدیل موجک بهینه ارائه کردند. برای تجزیهوتحلیل دادههای سیگنالهای الکتروانسفالوگرافی، از روش تبدیل موجک گسسته به منظور تجزیه آنها به زیرباندهای متعدد و استخراج اطلاعات آماری مختلف از هریک استفاده شده است. درنتیجه، رویکردهای ضریب همبستگی و ویژگی P (CCP) و تحلیل مؤلفه اصلی برای به حداقل رساندن اختصاصیت مورد استفاده قرار گرفتند. مدل حافظه کوتاهمدت ماندگار با لایههای پیشنهادی برای طبقهبندی ویژگیهای ورودی استفاده شد که منجر به دقت 99 درصد شد. محققان [50] ویژگیهای هارالیک را به عنوان روشی برای تشخیص تشنجهای صرع از سیگنالهای الکتروانسفالوگرافی در نظر گرفتند که با استفاده از تبدیل فوریه کوتاهمدت برای استخراج ویژگیهای هارالیک به تصاویر دوبعدی تبدیل شدند. درنهایت از روش درخت تصمیم برای طبقهبندی استفاده شد و نتایج تحقیق با دقت 92/50 درصد به دست آمد. همچنین محققان [51] از نظریههای FD و گراف برای استخراج ویژگی استفاده کردند و از روش ECT برای پیشپردازش سیگنالهای الکتروانسفالوگرافی به عنوان اولین مرحله مطالعه استفاده کردند. سپس، آنها نظریه گراف و ویژگیهای مبتنی بر ابعاد فراکتال را از سیگنالهای الکتروانسفالوگرافی استخراج کردند. درنهایت از روش RF برای طبقهبندی استفاده کردند و به دقت 98/50 درصد رسیدند.
این مقاله یک روش جدید مبتنی بر استخراج ویژگیهای غیرخطی، کاهش ویژگی DL و روش طبقهبندی SVM-GOA ارائه میدهد. در این مقاله، از سیگنالهای الکتروانسفالوگرافی مجموعه داده بن، برای تشخیص تشنج صرع استفاده شده است. تصویر شماره 1 قطعه نموداری از روش پیشنهادی برای تشخیص تشنج صرع از سیگنالهای الکتروانسفالوگرافی را نشان میدهد.
صرع یک خطر عصبی مزمن غیر قابل انتقال است که ممکن است بر روی افراد در هر سنی تأثیر بگذارد [1]. ممکن است از آن به عنوان یک بیماری شایع مغزی یاد شود. تقریباً 50 میلیون نفر در سراسر جهان به شکل اغراقآمیزی به آن مبتلا هستند. 80 درصد مبتلایان به این بیماری در کشورهای متوسط و کمدرآمد زندگی میکنند. در صورت درمان و تشخیص مناسب، 70 درصد از افراد مبتلا به این بیماری میتوانند به زندگی بدون تشنج برسند. خطر مرگ زودرس در افراد مبتلا به صرع 3 برابر بیشتر از افراد عادی است. سهچهارم بیماران صرعی که در کشورهای در حال توسعه زندگی میکنند، نمیتوانند به درمان لازم بپردازند [2]. چنین بیمارانی و خانوادههایشان از تبعیض و انگ رنج میبرند. صرع دو نوع عمومی و کانونی دارد [3]. اثرات صرع کانونی بر روی ناحیهای از مغز است و پیدا کردن بخشی از مغز که تحت تأثیر صرع کانونی قرار گرفته است برای مراقبتهای پزشکی مهم است. شصت درصد بیماران صرع کانونی و بیست درصد بیماران مبتلا به صرع عمومی به دارو مقاوم میشوند و برای چنین بیمارانی نیاز به عمل جراحی است [4].
روشهای مختلفی برای تشخیص تشنج صرع ارائه شده است، از جمله روشهای بالینی و روشهای تصویربرداری عصبی [2 ،1] که در میان آنها روشهای تصویربرداری عصبی به طور گسترده توسط پزشکان استفاده میشود [2 ،1]. به طور کلی، روشهای تصویربرداری عصبی به روشهای عملکردی و ساختاری طبقهبندی میشوند [1 ,2, 3] و ثبت سیگنالهای الکتروانسفالوگرافی یک روش تشخیص تشنج صرع بر اساس روشهای تصویربرداری عصبی عملکردی است [2 ،1]. سیگنالهای الکتروانسفالوگرافی اطلاعات ضروری را از محل تشنج صرع ارائه میدهند که به پزشکان کمک میکند تا تشنجهای صرعی را با دقت بالاتر تشخیص دهند [1 ,2, 3].
تشخیص تشنجهای صرع از طریق سیگنالهای الکتروانسفالوگرافی کاری چالشبرانگیز برای پزشکان متخصص است [2 ،1]. سیگنالهای الکتروانسفالوگرافی با پیچیدگی نسبتاً زیادی همراه هستند و برای تشخیص صحیح، چالش و دشواری ایجاد میکنند [2 ،1]. بر این اساس، با استفاده از روش هوش مصنوعی، هدف محققان تشخیص زودهنگام تشنجهای صرع از طریق سیگنالهای الکتروانسفالوگرافی است. تشنجهای صرع با استفاده از یادگیری ماشینی [4 ,5, 6] و یادگیری عمیق [7, 8] انجام میشوند که از جمله تکنیکهای هوش مصنوعی هستند.
در CADS مبتنی بر ML، تکنیکهای استخراج ویژگی شامل زمان، فرکانس، زمان ـ فرکانس و روشهای غیرخطی [9, 10, 11, 12] است. همچنین در CADS مبتنی بر روشهای DL تکنیکهای تشخیص تشنجهای صرع، رمزنگارهای خودکار، شبکههای عصبی بازگشتی، شبکههای عصبی کانولوشن و شبکههای باور عمیق هستند [13, 14, 15, 16, 17, 18, 19].
عابدین و همکاران [45] یک روش تشخیص تشنج صرع را بر اساس ویژگیهای آماری ارائه کردند و به نتایج امیدوارکنندهای دست یافتند. این مطالعه ابتدا از یک مجموعه داده بن و روش تبدیل موجک گسسته برای پیشپردازش و تجزیهوتحلیل سیگنالهای الکتروانسفالوگرافی به زیرباندهای مختلف استفاده کرد. سپس، هر زیرباند DWT برای استخراج برخی از ویژگیهای آماری مورد بررسی قرار گرفت و شبکه عصبی مصنوعی برای طبقهبندی دادهها استفاده شد. سینگ و همکاران [47] روش جدیدی برای تشخیص تشنج صرع از سیگنالهای الکتروانسفالوگرافی مجموعه داده بن پیشنهاد کردند. آنها از روشهای تجزیهی مد تجربی یکپارچه کامل، یعنی تجزیه مجموعههای تکمیلی حالت تجربی و آنتروپی پراکندگی چند مقیاس تصفیهشده برای انجام پیش پردازش و استخراج خواص استفاده کردند و روشهای مختلفی را برای انتخاب ویژگی آزمایش کردند تا اندازه ماتریس ویژگی را کاهش دهند. درنهایت، تکنیک طبقهبندی شبکه عصبی مصنوعی استفاده شد و به نتایج امیدوارکنندهای منجر شد. علیو و همکاران [49] یک تشخیص تشنج صرع را بر اساس انتخاب تبدیل موجک بهینه ارائه کردند. برای تجزیهوتحلیل دادههای سیگنالهای الکتروانسفالوگرافی، از روش تبدیل موجک گسسته به منظور تجزیه آنها به زیرباندهای متعدد و استخراج اطلاعات آماری مختلف از هریک استفاده شده است. درنتیجه، رویکردهای ضریب همبستگی و ویژگی P (CCP) و تحلیل مؤلفه اصلی برای به حداقل رساندن اختصاصیت مورد استفاده قرار گرفتند. مدل حافظه کوتاهمدت ماندگار با لایههای پیشنهادی برای طبقهبندی ویژگیهای ورودی استفاده شد که منجر به دقت 99 درصد شد. محققان [50] ویژگیهای هارالیک را به عنوان روشی برای تشخیص تشنجهای صرع از سیگنالهای الکتروانسفالوگرافی در نظر گرفتند که با استفاده از تبدیل فوریه کوتاهمدت برای استخراج ویژگیهای هارالیک به تصاویر دوبعدی تبدیل شدند. درنهایت از روش درخت تصمیم برای طبقهبندی استفاده شد و نتایج تحقیق با دقت 92/50 درصد به دست آمد. همچنین محققان [51] از نظریههای FD و گراف برای استخراج ویژگی استفاده کردند و از روش ECT برای پیشپردازش سیگنالهای الکتروانسفالوگرافی به عنوان اولین مرحله مطالعه استفاده کردند. سپس، آنها نظریه گراف و ویژگیهای مبتنی بر ابعاد فراکتال را از سیگنالهای الکتروانسفالوگرافی استخراج کردند. درنهایت از روش RF برای طبقهبندی استفاده کردند و به دقت 98/50 درصد رسیدند.
این مقاله یک روش جدید مبتنی بر استخراج ویژگیهای غیرخطی، کاهش ویژگی DL و روش طبقهبندی SVM-GOA ارائه میدهد. در این مقاله، از سیگنالهای الکتروانسفالوگرافی مجموعه داده بن، برای تشخیص تشنج صرع استفاده شده است. تصویر شماره 1 قطعه نموداری از روش پیشنهادی برای تشخیص تشنج صرع از سیگنالهای الکتروانسفالوگرافی را نشان میدهد.
پزشکان باید سیگنالهای الکتروانسفالوگرافی را در فرکانسهای خاص آنالیز کنند تا تشنجهای صرع را بهدرستی تشخیص دهند. تبدیل موجک پرکاربردترین روش برای پیشپردازش و استخراج فرکانسهای قابل توجه از سیگنالهای الکتروانسفالوگرافی است. انواع مختلفی از تبدیلهای بنفش در تحقیقات مختلف مورد استفاده قرار گرفتهاند که در میان آنها رویکرد تبدیل موجک عامل Q قابل تنظیم یکی از بهترین روشها برای پیشپردازش سیگنالهای الکتروانسفالوگرافی است [20]. نشان داده شده است که این روش نسبت به روش تبدیل موجک گسسته در زمینه پیشپردازش و تجزیهوتحلیل سیگنالهای الکتروانسفالوگرافی به زیرباندهای فرکانس مختلف کارآمدتر است. بنابراین، این مقاله از تبدیل موجک عامل Q قابل تنظیم برای پیشپردازش و تجزیهوتحلیل سیگنالهای الکتروانسفالوگرافی مجموعه داده بن استفاده کرد. پارامترهای تبدیل موجک عامل Q قابل تنظیم مشابه Q=1و r = 3 و J = 8 [34] انتخاب شدند و تجزیهوتحلیل سیگنالهای الکتروانسفالوگرافی با روش تبدیل موجک عامل Q قابل تنظیم منجر به استخراج خواص مهم از زیر باندهای فرکانس شد که میتواند میزان دقت تشخیص تشنج صرع را افزایش دهد.
در مرحله بعد، ویژگیهای آماری و غیرخطی مختلفی از سیگنالهای الکتروانسفالوگرافی استخراج میشود و پنج لحظه آماری، ویژگیهای غیرخطی مانند رویکردهای FD و آنتروپی از زیرباندهای تبدیل موجک عامل Q قابل تنظیم بازیابی میشوند. هیگوچی، کاتز، پتروسیان، و نمای هرست برخی از ویژگیهای غیرخطی مبتنی بر فراکتالها هستند و شانون، نمودار انرژی، نمونه، تسالیس، فازی، بازگشتی، طیفی و نمودار از جمله ویژگیهای غیرخطی مبتنی بر آنتروپی هستند. در نتیجه، درمجموع 153 ویژگی از هر فریم سیگنال الکتروانسفالوگرافی استخراج شد. مدل AE با لایههای پیشنهادی برای کاهش ویژگی به عنوان اولین تازگی این مقاله استفاده شد و ویژگیها را از 153 به 32 کاهش داد.
علاوه بر این، چندین رویکرد یادگیری ماشینی شامل SVM ،SVM-GOA ،KNN و RF برای طبقهبندی استفاده میشوند. دومین نکته جدید این مقاله استفاده از الگوریتم GOA در ارتباط با طبقهبندی SVM است. الگوریتم GOA یک روش بهینهسازی جدید است که تاکنون در تشخیص تشنج صرع همراه با SVM استفاده نشده است. رویکرد GOA از روشهای بهینهسازی گرادیان از نظر سرعت و عملکرد بهتر عمل میکند. الگوریتمهای بهینهسازی گرادیان معمولاً کند هستند و انتخاب پارامترهای نادرست میتواند منجر به کارایی نامناسب شود. علاوه بر این، روشهای گرادیان در همه مسائل کارآمد نیستند. بنابراین، الگوریتمهای فراابتکاری، از جمله الگوریتم ژنتیک [53]، بهینهسازی ازدحام ذرات [54]، ازدحام پرورش (BS) [55] و غیره، برای بهینهسازی الگوریتمهای طبقهبندی استفاده میشوند.
مواد و روشها
در این بخش روش پیشنهادی برای تشخیص تشنج صرع در سیگنالهای الکتروانسفالوگرافی ارائه شده است. روش پیشنهادی شامل مراحل انتخاب داده، پیشپردازش، استخراج ویژگی، انتخاب ویژگی و درنهایت طبقهبندی است.
مجموعه داده
مجموعه داده بُن
مجموعه داده بن توسط گروهی از محققین در دانشگاه بن ثبت شد و به طور گسترده در زمینه تجزیهوتحلیل و تشخیص تشنج صرع استفاده شده بود [22]. مجموعه داده بنُ دادههای تککانالی 500 سیگنال الکتروانسفالوگرافی در دسترس عموم است. از آن در 173/6 هرتز با مدت زمان 23/6 ثانیه نمونهبرداری شد. آنها از پنج کلاس تشکیل شده بودند. S، F، N، O و Z با 100 کانال ثبتشده در هر کلاس [22]. پنج کنترل سالم در حالت آرام و بیدار با طرح قرار دادن الکترود استاندارد 10-20 به دادههای سطح سیگنالهای الکتروانسفالوگرافی کلاس O و Z کمک کردند. برای جمعآوری دادههای کلاسهای S ،F و N از الکترودهای داخلجمجمهای برای پنج بیمار مبتلا به صرع استفاده شد. نیمکره ناحیه صرعزا و نیمکره مخالف به ترتیب برای ثبت سیگنالهای کلاسهای F و S در طول دوره اینترکتال استفاده شد. در مورد ثبت طبقه S دوره ایکتال در نظر گرفته شد. فرکانسهای برش در محدوده 0/53 تا 40 هرتز با واکنش متناهی ضربه با فیلتر باند میانگذر 20 مرتبه برای فیلتر کردن دادههای سیگنالهای الکتروانسفالوگرافی اعمال شد[22]. تصویر شماره 2 سیگنالهای الکتروانسفالوگرافی مجموعه داده بن را نشان میدهد.
در مرحله بعد، ویژگیهای آماری و غیرخطی مختلفی از سیگنالهای الکتروانسفالوگرافی استخراج میشود و پنج لحظه آماری، ویژگیهای غیرخطی مانند رویکردهای FD و آنتروپی از زیرباندهای تبدیل موجک عامل Q قابل تنظیم بازیابی میشوند. هیگوچی، کاتز، پتروسیان، و نمای هرست برخی از ویژگیهای غیرخطی مبتنی بر فراکتالها هستند و شانون، نمودار انرژی، نمونه، تسالیس، فازی، بازگشتی، طیفی و نمودار از جمله ویژگیهای غیرخطی مبتنی بر آنتروپی هستند. در نتیجه، درمجموع 153 ویژگی از هر فریم سیگنال الکتروانسفالوگرافی استخراج شد. مدل AE با لایههای پیشنهادی برای کاهش ویژگی به عنوان اولین تازگی این مقاله استفاده شد و ویژگیها را از 153 به 32 کاهش داد.
علاوه بر این، چندین رویکرد یادگیری ماشینی شامل SVM ،SVM-GOA ،KNN و RF برای طبقهبندی استفاده میشوند. دومین نکته جدید این مقاله استفاده از الگوریتم GOA در ارتباط با طبقهبندی SVM است. الگوریتم GOA یک روش بهینهسازی جدید است که تاکنون در تشخیص تشنج صرع همراه با SVM استفاده نشده است. رویکرد GOA از روشهای بهینهسازی گرادیان از نظر سرعت و عملکرد بهتر عمل میکند. الگوریتمهای بهینهسازی گرادیان معمولاً کند هستند و انتخاب پارامترهای نادرست میتواند منجر به کارایی نامناسب شود. علاوه بر این، روشهای گرادیان در همه مسائل کارآمد نیستند. بنابراین، الگوریتمهای فراابتکاری، از جمله الگوریتم ژنتیک [53]، بهینهسازی ازدحام ذرات [54]، ازدحام پرورش (BS) [55] و غیره، برای بهینهسازی الگوریتمهای طبقهبندی استفاده میشوند.
مواد و روشها
در این بخش روش پیشنهادی برای تشخیص تشنج صرع در سیگنالهای الکتروانسفالوگرافی ارائه شده است. روش پیشنهادی شامل مراحل انتخاب داده، پیشپردازش، استخراج ویژگی، انتخاب ویژگی و درنهایت طبقهبندی است.
مجموعه داده
مجموعه داده بُن
مجموعه داده بن توسط گروهی از محققین در دانشگاه بن ثبت شد و به طور گسترده در زمینه تجزیهوتحلیل و تشخیص تشنج صرع استفاده شده بود [22]. مجموعه داده بنُ دادههای تککانالی 500 سیگنال الکتروانسفالوگرافی در دسترس عموم است. از آن در 173/6 هرتز با مدت زمان 23/6 ثانیه نمونهبرداری شد. آنها از پنج کلاس تشکیل شده بودند. S، F، N، O و Z با 100 کانال ثبتشده در هر کلاس [22]. پنج کنترل سالم در حالت آرام و بیدار با طرح قرار دادن الکترود استاندارد 10-20 به دادههای سطح سیگنالهای الکتروانسفالوگرافی کلاس O و Z کمک کردند. برای جمعآوری دادههای کلاسهای S ،F و N از الکترودهای داخلجمجمهای برای پنج بیمار مبتلا به صرع استفاده شد. نیمکره ناحیه صرعزا و نیمکره مخالف به ترتیب برای ثبت سیگنالهای کلاسهای F و S در طول دوره اینترکتال استفاده شد. در مورد ثبت طبقه S دوره ایکتال در نظر گرفته شد. فرکانسهای برش در محدوده 0/53 تا 40 هرتز با واکنش متناهی ضربه با فیلتر باند میانگذر 20 مرتبه برای فیلتر کردن دادههای سیگنالهای الکتروانسفالوگرافی اعمال شد[22]. تصویر شماره 2 سیگنالهای الکتروانسفالوگرافی مجموعه داده بن را نشان میدهد.
همچنین سایر اطلاعات این پایگاه درجدولهای شماره 1 و 2 آمده است.
.jpg)
.jpg)
پیشپردازش
تبدیل موجک عامل Q قابل تنظیم
نوع خاصی از تبدیل موجک گسسته است و در تحقیقات سیگنال زیست پزشکی استفاده شده است [20]. در تبدیل موجک عامل Q قابل تنظیم، افزونگی، تعداد سطوح تجزیه و فاکتور Q را میتوان تنظیم کرد. سیگنالهای نوسانی با مقدار Q بالا و سیگنالهای گذرا با مقدار Q پایین تجزیهوتحلیل میشوند. مفهوم بانک فیلتر دو کاناله در تبدیل موجک عامل Q قابل تنظیم اعمال میشود. فاکتورهای مقیاس پایین و بالا گذر برای بانکهای فیلتر با دو کانال با γ و δ نشان داده میشوند. عبارت ریاضی پاسخ فرکانس فیلتر پایین گذر در فرمول شماره 1 آمده است [20]:
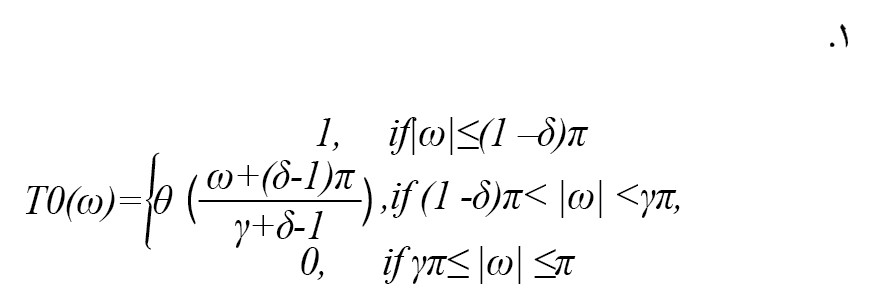
عبارت ریاضی پاسخ فرکانس فیلتر بالا گذردر فرمول شماره 2 آمده است:
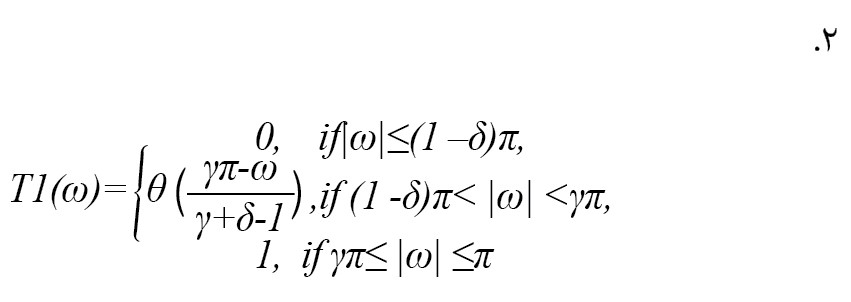
اطلاعات بیشتر در مورد تبدیل موجک عامل Q قابل تنظیم در برخی منابع ارائه شده است [20]. این مقاله Q ،J، و r را به ترتیب 8، 3 و 1 تعریف میکند. در تصویر شماره 3، زیرباندهای تبدیل موجک عامل Q قابل تنظیم بر اساس پارامترهای تعریفشده نشان داده شدهاند.
.jpg)
.jpg)
پیشپردازش
تبدیل موجک عامل Q قابل تنظیم
نوع خاصی از تبدیل موجک گسسته است و در تحقیقات سیگنال زیست پزشکی استفاده شده است [20]. در تبدیل موجک عامل Q قابل تنظیم، افزونگی، تعداد سطوح تجزیه و فاکتور Q را میتوان تنظیم کرد. سیگنالهای نوسانی با مقدار Q بالا و سیگنالهای گذرا با مقدار Q پایین تجزیهوتحلیل میشوند. مفهوم بانک فیلتر دو کاناله در تبدیل موجک عامل Q قابل تنظیم اعمال میشود. فاکتورهای مقیاس پایین و بالا گذر برای بانکهای فیلتر با دو کانال با γ و δ نشان داده میشوند. عبارت ریاضی پاسخ فرکانس فیلتر پایین گذر در فرمول شماره 1 آمده است [20]:
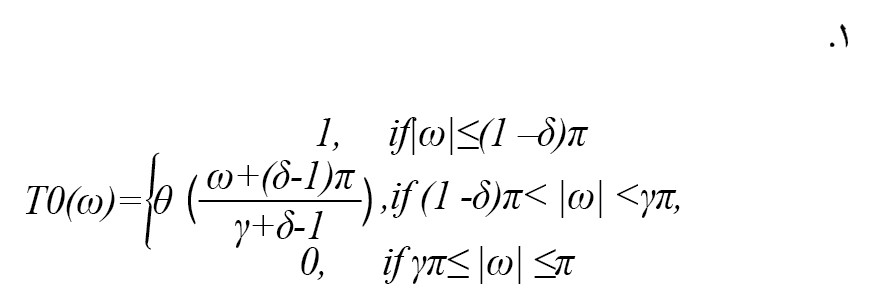
عبارت ریاضی پاسخ فرکانس فیلتر بالا گذردر فرمول شماره 2 آمده است:
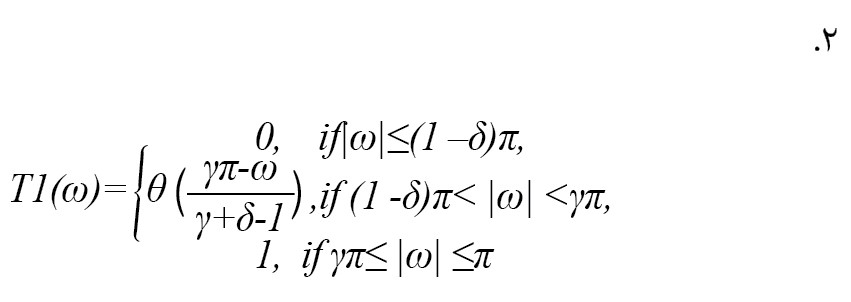
اطلاعات بیشتر در مورد تبدیل موجک عامل Q قابل تنظیم در برخی منابع ارائه شده است [20]. این مقاله Q ،J، و r را به ترتیب 8، 3 و 1 تعریف میکند. در تصویر شماره 3، زیرباندهای تبدیل موجک عامل Q قابل تنظیم بر اساس پارامترهای تعریفشده نشان داده شدهاند.
همچنین پاسخ فرکانس موجک در تصویر شماره 4 ترسیم شده است.
استخراج ویژگی
در این بخش، روشهای مختلف استخراج ویژگی برای تشخیص تشنج صرع را ارائه میکنیم. در ابتدا، تبدیل موجک عامل Q قابل تنظیم برای تجزیه سیگنالهای الکتروانسفالوگرافی استفاده شد و در ادامه، ویژگیهای متفاوتی مانند آماری، غیرخطی بر اساس فراکتال و غیرخطی بر اساس آنتروپی در زیرباندهای تبدیل موجک عامل Q قابل تنظیم استخراج شد.
ویژگیهای آماری
ویژگیهای آماری در این بخش معرفی شده است. در این مقاله، پنج لحظه آماری از زیرباندهای تبدیل موجک عامل Q قابل تنظیم استخراج شده است [23]. جدول شماره 3 ویژگیهای آماری برای تشخیص تشنجهای صرع در سیگنالهای الکتروانسفالوگرافی را نشان میدهد.
.jpg)
ویژگیهای فراکتال
در این بخش، ویژگیهای فراکتال از زیرباندهای تبدیل موجک عامل Q قابل تنظیم استخراج میشود. در حوزه پردازش سیگنالهای مغزی، ویژگیهای فراکتال اطلاعات مهمی را در مورد سیگنالهای الکتروانسفالوگرافی ارائه میکنند. سیگنالهای الکتروانسفالوگرافی رفتار آشفتهای دارند و روشهای غیرخطی، به عنوان مثال، تکنیک فراکتال، میتوانند اطلاعات مهمی را از این دادهها استخراج کنند. این مقاله ویژگیهای فراکتال، از جمله کاتز، هیگوچی، و پتروسیان را از زیرباندهای تبدیل موجک عامل Q قابل تنظیم استخراج میکند. هر روش در ادامه مورد بررسی قرار گرفته است.
هیگوچی فراکتال
x(1)، x(2)،…….، x(N) دنباله زمانی مورد بررسی را در نظر بگیرید. k سری زمانی جدید Xmk را به عنوان [12] ایجاد کنید (فرمول شماره 3).
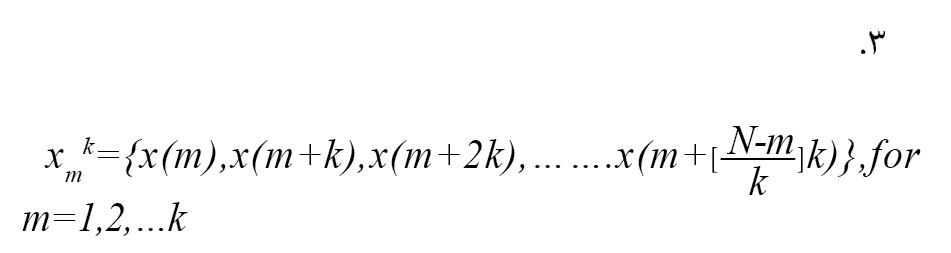
در جایی که [a] قسمت صحیح a را نشان میدهد، k به معنای فاصله زمانی گسسته بین نقاط، m به معنای مقدار زمانی اولیه است. برای هر سری زمانی Xmk ایجادشده، میانگین طول Lm(k) به صورت فرمول شماره 4 محاسبه میشود [12].
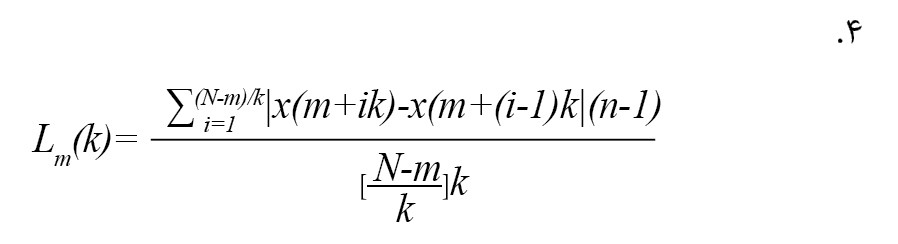
تأخیر k در تمام سریهای زمانی با طول متوسط k، به صورت میانگین طولهای k Lm(k) برای m=1,….,k محاسبه میشود. برای هر k از 1 تا Kmax، این روش تکرار میشود و مجموع طولهای متوسط L(k) برای هر k همانطور که در فرمول شماره 5 نشان داده شده است [12] تولید میشود.

L(k) متناسب با k-D، که در آن D ،FD توسط الگوریتم برای طول متوسط کل برای مقیاس k است [12].
کاتز فراکتال
بعد فراکتال یک منحنی را میتوان به صورت فرمول شماره 6 اراده کرد [12].

به طوری که در آن d قطر تخمین زدهشده به منظور فاصله بین نقاط دنبالهای است که دورترین فاصله و اولین نقطه دنباله را فراهم میکند و L طول کل منحنی است. d را میتوان از نظر ریاضی به صورت فرمول شماره 7 بیان کرد [12]:
7.
d=max(distance(1,i)
نقطه i همان نقطهای است که با اولین نقطه حداکثر میشود. اندازهگیری واحدهای مورد استفاده به FDهای محاسبهشده بستگی دارد. اگر واحدها متفاوت باشند، FDها متفاوت هستند. رویکرد کاتز سعی میکند با ایجاد یک واحد عمومی مشکل را حل کند [12] (فرمول شماره 8).

اگر n=L/a، که در آن n تعداد مراحل منحنی است باشد، معادله مذکور را میتوان به صورت زیر نوشت که استراتژی کاتز برای اندازهگیری بعد فراکتال سیگنال الکتروانسفالوگرافی را خلاصه میکند [12] (فرمول شماره 9).
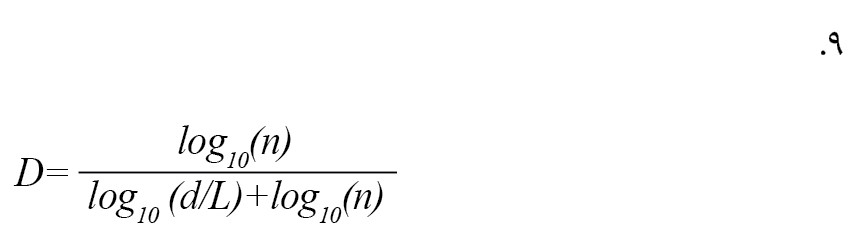
فراکتال پتروسیان
در این بخش روش پتروسیان ارائه شده است. معادله این تکنیک فراکتال به صورت فرمول شماره 10 است [12].

به طوری که در آن N∆ تعداد جفتهای غیرمشابه و n طول دنباله در دنباله باینری به دست آمده است [12].
نمودارهرست
معادله توان هرست به صورت فرمول شماره 11 است [25].

به طوری که S انحراف استاندارد است، T مدتزمان دادههای نمونه و R نشاندهنده تفاوت بین حداقل و حداکثر انحراف از میانگین است.
ویژگیهای آنتروپی
در این مقاله، آنتروپیهای مختلف برای استخراج مشخصه سیگنالهای الکتروانسفالوگرافی مورد بهرهبرداری قرار میگیرند. در ادامه معادلات تمامی آنتروپیها شرح داده شده است.
آنتروپی شانون
آنتروپی شانون، تکنیک آنتروپی اساسی برای استخراج ویژگی در سیگنالهای الکتروانسفالوگرافی است [26]. معادله آنتروپی شانون به صورت فرمول شماره 12 است.

به طوری که در این فرمول، Pi احتمال وقوع یک نماد معین است.
نمودار LOg آنتروپی انرژی
لگ آنتروپی انرژی را میتوان به صورت فرمول شماره 13 نشان داد [26].

به طوری که در آن K و Ei به ترتیب طول سیگنال الکتروانسفالوگرافی و nامین نمونه سیگنال الکتروانسفالوگرافی را نشان میدهند.
آنتروپی نمونه
در فرمول شماره 14، فرمول آنتروپی نمونه نشان داده شده است [26].
14.
SampEn=-log(A/B)
به طوری که A به تعداد کل جفت بردارهای طول m + 1 اشاره دارد. همچنین، B شامل تعداد کل جفتهای بردار طول m است.
آنتروپی تسالیس
در فرمول شماره 15، آنتروپی تسالی معرفی شده است [26].

به طوری که در آن احتمال وقوع به منظور En نامیده میشود و Pn مقدار ویژگی P است که محدوده مقادیر از P1 تا Px را دارد [27].
آنتروپی فازی
برای سری زمانی x(i),i={1,…..,N}، آنتروپی فازی استاندارد یا FuZZy En [27] دنبالههای برداری {{Xim,i=1,….,N-m+1 به صورت فرمول شماره 16 [26] ارائه شده است.
16.
Xim={x(i),x(i+1),…,x(i+m-1)}-x0 (i)
به طوری که طول دنبالهها با m نشان داده میشود، x0 (i) یک خط مبناست [26].
Dmij (n,r) درجه تشابه با استفاده از تابع عضویت فازی μ(Dmij,n,r) برای بردار Xim و Xjm جایگزین تابع هوی ساید است (فرمول شماره 17) [26].
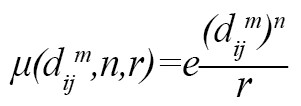
به طوری که r و n گرادیان و عرض تابع نموداری از پیش تعریفشده هستند، Dijm حداکثر اختلاف مطلق بین Xim و Xjm هستند. تابع به صورت فرمول شماره 18 تعریف میشود [26].
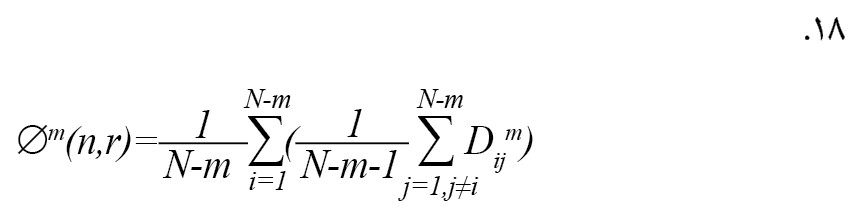
دنبالههای {Xi(m+1)} با تنظیم m←m+1 تولید میشوند و ∅m(n,r) پس از آن ساخته میشوند. سری زمانی برای ورودی x(i) برای FuZZyEn، ∅m(n,r) با انحراف از ∅(m+1) (n,r) تولید میشود که در فرمول شماره 19 نشان داده شده است [26].
19.
FuzzyEn(m,n,t,N)=ln ∅m(n,r)-ln∅(m+1)(n,r)
آنتروپی بازگشتی
معادله آنتروپی بازگشتی به صورت فرمول شماره 20 است [26].
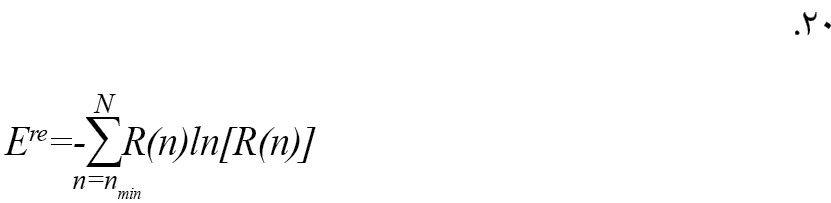
به طوری که R(n) توزیع فرکانس طول n خطوط مورب است [26].
آنتروپی طیفی
SEN به صورت فرمول شماره 21 نشان داده میشود [26].

آنتروپی نمودار
یک روش جدید استخراج ویژگی مبتنی بر نظریه گراف در این بخش ارائه شده است. آنتروپی مبتنی بر نظریه گراف در فرمول شماره 22 و 23 ارائه شده است [27].
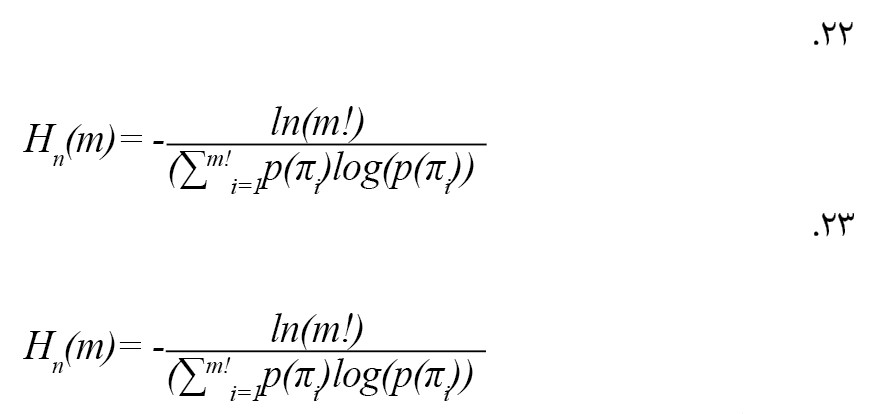
کاهش ویژگی با استفاده از AutOencOder
کاهش ویژگی یکی از مراحل مهم در سیستم CADS تشخیص بیماری است. هدف اصلی کاهش ویژگی، اعمال ویژگیهای مهم در ورودی الگوریتمهای طبقهبندی است [28]. این امر سرعت طبقهبندی و دقت دادههای ورودی را افزایش میدهد [28]. کاهش ویژگی به طور منظم با یادگیری ماشین معمولی و تکنیکهای DL انجام میشود. در این مقاله از مدل AE و تعداد لایههای پیشنهادی برای کاهش ویژگی استفاده شده است. بر خلاف تکنیکهای مرسوم، به عنوان مثال، PCA، کاهش ویژگی روش AE عملکرد بالاتری دارد [28]. AE پیشنهادی دارای هفت لایه است. تصویر شماره 5 AE را با لایههای پیشنهادی نشان میدهد. این روش یکی دیگر از نوآوریهای مقاله است.
در این بخش، روشهای مختلف استخراج ویژگی برای تشخیص تشنج صرع را ارائه میکنیم. در ابتدا، تبدیل موجک عامل Q قابل تنظیم برای تجزیه سیگنالهای الکتروانسفالوگرافی استفاده شد و در ادامه، ویژگیهای متفاوتی مانند آماری، غیرخطی بر اساس فراکتال و غیرخطی بر اساس آنتروپی در زیرباندهای تبدیل موجک عامل Q قابل تنظیم استخراج شد.
ویژگیهای آماری
ویژگیهای آماری در این بخش معرفی شده است. در این مقاله، پنج لحظه آماری از زیرباندهای تبدیل موجک عامل Q قابل تنظیم استخراج شده است [23]. جدول شماره 3 ویژگیهای آماری برای تشخیص تشنجهای صرع در سیگنالهای الکتروانسفالوگرافی را نشان میدهد.
.jpg)
ویژگیهای فراکتال
در این بخش، ویژگیهای فراکتال از زیرباندهای تبدیل موجک عامل Q قابل تنظیم استخراج میشود. در حوزه پردازش سیگنالهای مغزی، ویژگیهای فراکتال اطلاعات مهمی را در مورد سیگنالهای الکتروانسفالوگرافی ارائه میکنند. سیگنالهای الکتروانسفالوگرافی رفتار آشفتهای دارند و روشهای غیرخطی، به عنوان مثال، تکنیک فراکتال، میتوانند اطلاعات مهمی را از این دادهها استخراج کنند. این مقاله ویژگیهای فراکتال، از جمله کاتز، هیگوچی، و پتروسیان را از زیرباندهای تبدیل موجک عامل Q قابل تنظیم استخراج میکند. هر روش در ادامه مورد بررسی قرار گرفته است.
هیگوچی فراکتال
x(1)، x(2)،…….، x(N) دنباله زمانی مورد بررسی را در نظر بگیرید. k سری زمانی جدید Xmk را به عنوان [12] ایجاد کنید (فرمول شماره 3).
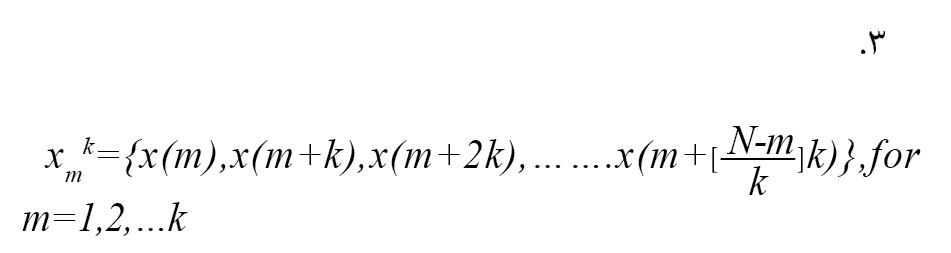
در جایی که [a] قسمت صحیح a را نشان میدهد، k به معنای فاصله زمانی گسسته بین نقاط، m به معنای مقدار زمانی اولیه است. برای هر سری زمانی Xmk ایجادشده، میانگین طول Lm(k) به صورت فرمول شماره 4 محاسبه میشود [12].
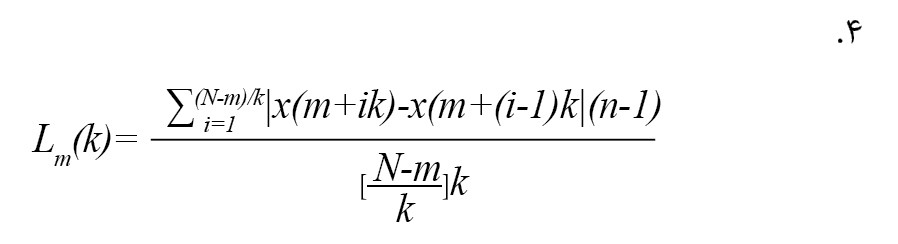
تأخیر k در تمام سریهای زمانی با طول متوسط k، به صورت میانگین طولهای k Lm(k) برای m=1,….,k محاسبه میشود. برای هر k از 1 تا Kmax، این روش تکرار میشود و مجموع طولهای متوسط L(k) برای هر k همانطور که در فرمول شماره 5 نشان داده شده است [12] تولید میشود.

L(k) متناسب با k-D، که در آن D ،FD توسط الگوریتم برای طول متوسط کل برای مقیاس k است [12].
کاتز فراکتال
بعد فراکتال یک منحنی را میتوان به صورت فرمول شماره 6 اراده کرد [12].

به طوری که در آن d قطر تخمین زدهشده به منظور فاصله بین نقاط دنبالهای است که دورترین فاصله و اولین نقطه دنباله را فراهم میکند و L طول کل منحنی است. d را میتوان از نظر ریاضی به صورت فرمول شماره 7 بیان کرد [12]:
7.
d=max(distance(1,i)
نقطه i همان نقطهای است که با اولین نقطه حداکثر میشود. اندازهگیری واحدهای مورد استفاده به FDهای محاسبهشده بستگی دارد. اگر واحدها متفاوت باشند، FDها متفاوت هستند. رویکرد کاتز سعی میکند با ایجاد یک واحد عمومی مشکل را حل کند [12] (فرمول شماره 8).

اگر n=L/a، که در آن n تعداد مراحل منحنی است باشد، معادله مذکور را میتوان به صورت زیر نوشت که استراتژی کاتز برای اندازهگیری بعد فراکتال سیگنال الکتروانسفالوگرافی را خلاصه میکند [12] (فرمول شماره 9).
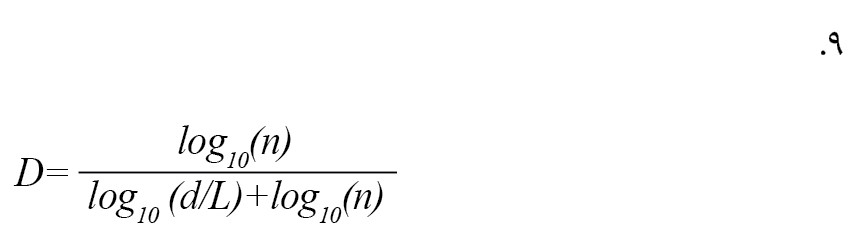
فراکتال پتروسیان
در این بخش روش پتروسیان ارائه شده است. معادله این تکنیک فراکتال به صورت فرمول شماره 10 است [12].

به طوری که در آن N∆ تعداد جفتهای غیرمشابه و n طول دنباله در دنباله باینری به دست آمده است [12].
نمودارهرست
معادله توان هرست به صورت فرمول شماره 11 است [25].

به طوری که S انحراف استاندارد است، T مدتزمان دادههای نمونه و R نشاندهنده تفاوت بین حداقل و حداکثر انحراف از میانگین است.
ویژگیهای آنتروپی
در این مقاله، آنتروپیهای مختلف برای استخراج مشخصه سیگنالهای الکتروانسفالوگرافی مورد بهرهبرداری قرار میگیرند. در ادامه معادلات تمامی آنتروپیها شرح داده شده است.
آنتروپی شانون
آنتروپی شانون، تکنیک آنتروپی اساسی برای استخراج ویژگی در سیگنالهای الکتروانسفالوگرافی است [26]. معادله آنتروپی شانون به صورت فرمول شماره 12 است.

به طوری که در این فرمول، Pi احتمال وقوع یک نماد معین است.
نمودار LOg آنتروپی انرژی
لگ آنتروپی انرژی را میتوان به صورت فرمول شماره 13 نشان داد [26].

به طوری که در آن K و Ei به ترتیب طول سیگنال الکتروانسفالوگرافی و nامین نمونه سیگنال الکتروانسفالوگرافی را نشان میدهند.
آنتروپی نمونه
در فرمول شماره 14، فرمول آنتروپی نمونه نشان داده شده است [26].
14.
SampEn=-log(A/B)
به طوری که A به تعداد کل جفت بردارهای طول m + 1 اشاره دارد. همچنین، B شامل تعداد کل جفتهای بردار طول m است.
آنتروپی تسالیس
در فرمول شماره 15، آنتروپی تسالی معرفی شده است [26].

به طوری که در آن احتمال وقوع به منظور En نامیده میشود و Pn مقدار ویژگی P است که محدوده مقادیر از P1 تا Px را دارد [27].
آنتروپی فازی
برای سری زمانی x(i),i={1,…..,N}، آنتروپی فازی استاندارد یا FuZZy En [27] دنبالههای برداری {{Xim,i=1,….,N-m+1 به صورت فرمول شماره 16 [26] ارائه شده است.
16.
Xim={x(i),x(i+1),…,x(i+m-1)}-x0 (i)
به طوری که طول دنبالهها با m نشان داده میشود، x0 (i) یک خط مبناست [26].
Dmij (n,r) درجه تشابه با استفاده از تابع عضویت فازی μ(Dmij,n,r) برای بردار Xim و Xjm جایگزین تابع هوی ساید است (فرمول شماره 17) [26].
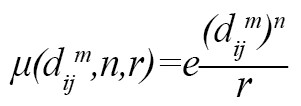
به طوری که r و n گرادیان و عرض تابع نموداری از پیش تعریفشده هستند، Dijm حداکثر اختلاف مطلق بین Xim و Xjm هستند. تابع به صورت فرمول شماره 18 تعریف میشود [26].
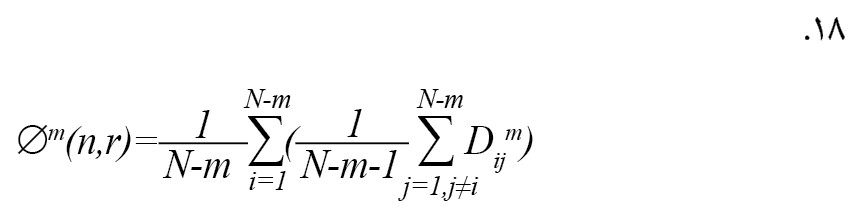
دنبالههای {Xi(m+1)} با تنظیم m←m+1 تولید میشوند و ∅m(n,r) پس از آن ساخته میشوند. سری زمانی برای ورودی x(i) برای FuZZyEn، ∅m(n,r) با انحراف از ∅(m+1) (n,r) تولید میشود که در فرمول شماره 19 نشان داده شده است [26].
19.
FuzzyEn(m,n,t,N)=ln ∅m(n,r)-ln∅(m+1)(n,r)
آنتروپی بازگشتی
معادله آنتروپی بازگشتی به صورت فرمول شماره 20 است [26].
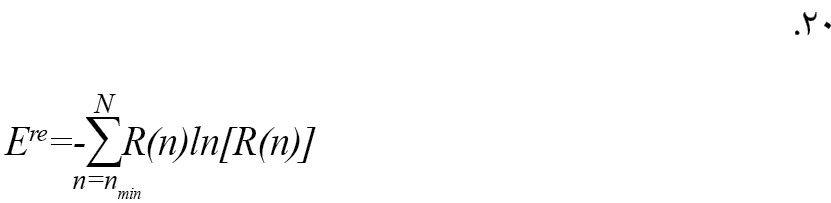
به طوری که R(n) توزیع فرکانس طول n خطوط مورب است [26].
آنتروپی طیفی
SEN به صورت فرمول شماره 21 نشان داده میشود [26].

آنتروپی نمودار
یک روش جدید استخراج ویژگی مبتنی بر نظریه گراف در این بخش ارائه شده است. آنتروپی مبتنی بر نظریه گراف در فرمول شماره 22 و 23 ارائه شده است [27].
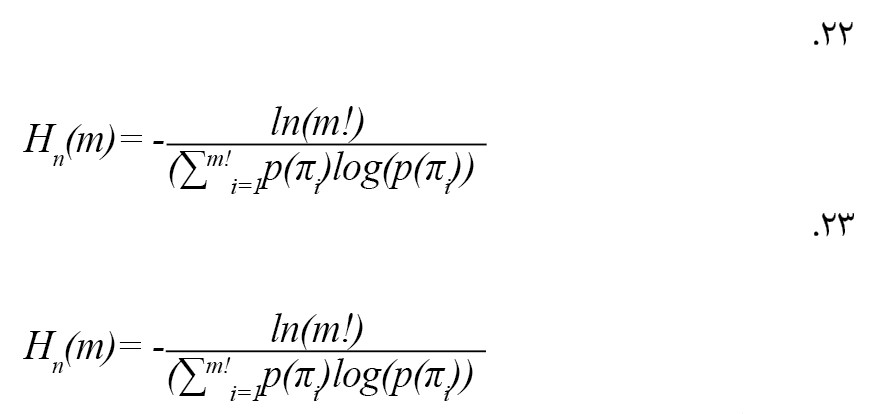
کاهش ویژگی با استفاده از AutOencOder
کاهش ویژگی یکی از مراحل مهم در سیستم CADS تشخیص بیماری است. هدف اصلی کاهش ویژگی، اعمال ویژگیهای مهم در ورودی الگوریتمهای طبقهبندی است [28]. این امر سرعت طبقهبندی و دقت دادههای ورودی را افزایش میدهد [28]. کاهش ویژگی به طور منظم با یادگیری ماشین معمولی و تکنیکهای DL انجام میشود. در این مقاله از مدل AE و تعداد لایههای پیشنهادی برای کاهش ویژگی استفاده شده است. بر خلاف تکنیکهای مرسوم، به عنوان مثال، PCA، کاهش ویژگی روش AE عملکرد بالاتری دارد [28]. AE پیشنهادی دارای هفت لایه است. تصویر شماره 5 AE را با لایههای پیشنهادی نشان میدهد. این روش یکی دیگر از نوآوریهای مقاله است.
در این بخش، 153 ویژگی به 32 ویژگی کاهش یافت.
طبقهبندی
ماشین بردار پشتیبان
SVM یکی از طبقهبندیکنندههای برجسته مورد استفاده در حوزه یادگیری ماشین است. ایده اصلی SVM ایجاد ابرصفحه جداکننده بهینه در فضای ویژگی است که حاشیه بین نزدیکترین نقاط داده هر کلاس و ابرصفحه را به حداکثر میرساند. در حالت تفکیکناپذیری خطی، از توابع هسته برای نگاشت نمونهها در یک فضای ویژگی با ابعاد بالاتر استفاده میشود که در آن دادهها به صورت خطی قابل تفکیک میشوند [29].
بهینهسازی GOA
SVM یکی از محبوبترین روشهای طبقهبندی است. با بهینه سازی پارامترهای مهم این روش از جمله هسته آن، میتوان دقت سیستم CAD برای تشخیص صرع را بهبود بخشید. در ادامه این بخش، الگوریتم GOA با رویکرد بهینهسازی روش طبقهبندی SVM تشریح میشود.
مدل اعمال شده برای شبیهسازی رفتار و حرکت ملخها به صورت فرمول شماره 24 ارائه شده است [21].
24.
mXi (t+1)=S1(t)+Gi(t)+Ai(t),
i=1,2,…,nPop t=1,2,…,tMax
از روابط مذکور، هریک از پارامترها به صورت زیر تعریف میشوند:
Xi (t): موقعیت ملخ iام در تکرار tام؛
Si (t): تعامل اجتماعی ملخ iام در تکرار tام؛
Gi (t): نیروی گرانش روی ملخ iام در تکرار tام؛
AI (t): فرارفت باد روی ملخ iام در تکرار tام.
در ادامه هریک از تعاریف مذکور به تفصیل مورد بررسی قرار میگیرد. تعامل اجتماعی ملخ با فرمول شماره 25 محاسبه میشود [21].

dij: فاصله بین ملخ iام و j ام، محاسبهشده به صورت dij=|x(i)-x(j)|
d ̂ij: بردار واحدی از ملخ iام به ملخ jام که به صورت d ̂ij=(x(i)-x(j))/dij محاسبه میشود.
S: تابعی برای تعریف قدرت نیروهای اجتماعی که به به صورت فرمول شماره 26توضیح داده شده است.
26.
s(d)=fe-e-d
که در آن f نشانگر شدت جاذبه و l مقیاس طول جذاب است. تابع s تأثیر تعاملات اجتماعی (دافعه و جاذبه) ملخها را نشان میدهد. تصویر شماره 6 الگوهای اصلاحی اولیه بین افراد را در دسته ای از ملخها نشان میدهد [21].
طبقهبندی
ماشین بردار پشتیبان
SVM یکی از طبقهبندیکنندههای برجسته مورد استفاده در حوزه یادگیری ماشین است. ایده اصلی SVM ایجاد ابرصفحه جداکننده بهینه در فضای ویژگی است که حاشیه بین نزدیکترین نقاط داده هر کلاس و ابرصفحه را به حداکثر میرساند. در حالت تفکیکناپذیری خطی، از توابع هسته برای نگاشت نمونهها در یک فضای ویژگی با ابعاد بالاتر استفاده میشود که در آن دادهها به صورت خطی قابل تفکیک میشوند [29].
بهینهسازی GOA
SVM یکی از محبوبترین روشهای طبقهبندی است. با بهینه سازی پارامترهای مهم این روش از جمله هسته آن، میتوان دقت سیستم CAD برای تشخیص صرع را بهبود بخشید. در ادامه این بخش، الگوریتم GOA با رویکرد بهینهسازی روش طبقهبندی SVM تشریح میشود.
مدل اعمال شده برای شبیهسازی رفتار و حرکت ملخها به صورت فرمول شماره 24 ارائه شده است [21].
24.
mXi (t+1)=S1(t)+Gi(t)+Ai(t),
i=1,2,…,nPop t=1,2,…,tMax
از روابط مذکور، هریک از پارامترها به صورت زیر تعریف میشوند:
Xi (t): موقعیت ملخ iام در تکرار tام؛
Si (t): تعامل اجتماعی ملخ iام در تکرار tام؛
Gi (t): نیروی گرانش روی ملخ iام در تکرار tام؛
AI (t): فرارفت باد روی ملخ iام در تکرار tام.
در ادامه هریک از تعاریف مذکور به تفصیل مورد بررسی قرار میگیرد. تعامل اجتماعی ملخ با فرمول شماره 25 محاسبه میشود [21].

dij: فاصله بین ملخ iام و j ام، محاسبهشده به صورت dij=|x(i)-x(j)|
d ̂ij: بردار واحدی از ملخ iام به ملخ jام که به صورت d ̂ij=(x(i)-x(j))/dij محاسبه میشود.
S: تابعی برای تعریف قدرت نیروهای اجتماعی که به به صورت فرمول شماره 26توضیح داده شده است.
26.
s(d)=fe-e-d
که در آن f نشانگر شدت جاذبه و l مقیاس طول جذاب است. تابع s تأثیر تعاملات اجتماعی (دافعه و جاذبه) ملخها را نشان میدهد. تصویر شماره 6 الگوهای اصلاحی اولیه بین افراد را در دسته ای از ملخها نشان میدهد [21].
تصویر شماره 6 الگوهای اصلاحی اولیه بین افراد در یک دسته ملخ را نشان میدهد [21].
نیروی گرانش روی ملخ iام به صورت فرمول شماره 27 تعریف میشود.
27.
Gi=-geg
به طوری که g نیروی گرانش است و eg نشاندهنده یک بردار واحد به سمت مرکز زمین است.
فرارفت باد روی ملخ iام به صورت فرمول شماره 28 محاسبه میشود[21].
28.
Ai=-uew
که u رانش ثابت و ew بردار واحد باد است. حال با توجه به تعاریف بهکاررفته، فرمول شماره 29 ارائه میشود [21].

معادله مذکور را نمیتوان به عنوان یک مسئله بهینهسازی استفاده کرد، زیرا الگوریتم را از کاوش و بهرهبرداری مناسب در فضای جستوجو در اطراف یک راه حل منع میکند. دلیل دوم این است که این معادله برای مدلسازی فضای باز است. برای اصلاح معادله مذکور و ارائه یک مدل عملکردی از الگوریتم GOA برای بهروزرسانی مکان هر ملخ، آن را به صورت زیر بازنویسی میکنیم (فرمول شماره 30) [21].
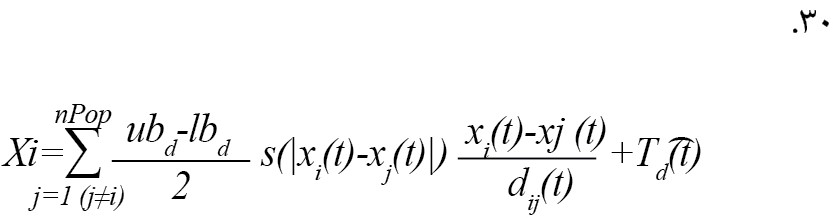
در معادله مذکور، پارامترهای جدید به صورت زیر بیان میشوند [21]:
ubd :کران بالایی در بعد Dام، lbd کران پایینی در بعد Dام است [21].
Td (d): مقدار بهترین راهحل بهدستآمده (تا تکرار tام) در بعد Dام و همچنین c به عنوان ضریب کاهشی در نظر گرفته میشود [21].
فرمول شماره 31 موقعیت بعدی ملخ بیان میکند [21].
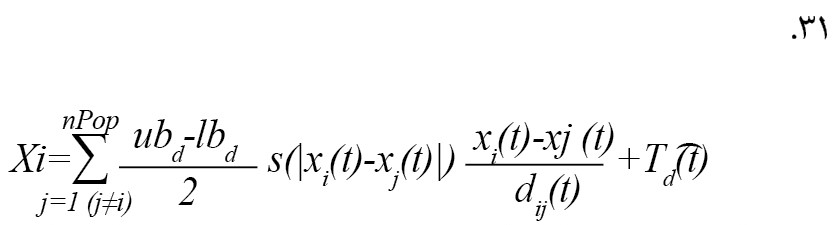
در معادله مذکور، xid (t+1) موقعیت بعدی ملخ i، x_i (t) موقعیت فعلی ملخ i، xj (t) موقعیت همه ملخهای دیگر و درنهایت Td (t) موقعیت هدف است [21].
بحث بعدی در مورد پارامتر c است. بهروزرسانی پارامتر c با فرمول شماره 32 انجام میشود [21].

در این معادله، cmax به عنوان حداکثر مقدار C (معمولاً نزدیک به 1)، cmin حداقل مقدار C (معمولاً نزدیک به صفر مثبت)، t تکرار فعلی و درنهایت، tMax حداکثر تکرار است. پارامتر مقایسهای c دو بار در این فرمول به دست میآید که دلایل آن به صورت زیر توضیح داده شده است [21].
c اول: بین اکتشاف و بهرهبرداری تعادل برقرار میکند. این c شباهت زیادی به پارامتر w در الگوریتم بهینهسازی PSO دارد [21].
c دوم: منطقه جذب، منطقه آسایش و منطقه دافعه بین ملخها را کاهش میدهد [57] (فرمول شماره 33).
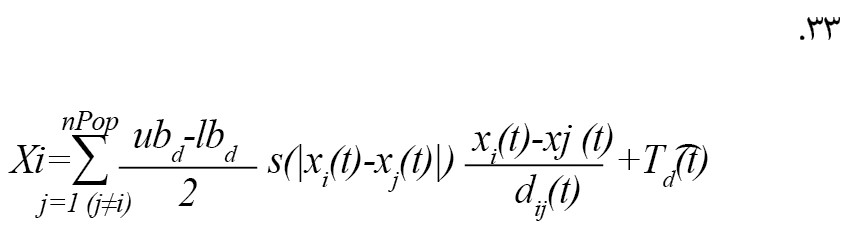
K- Nearest NeighbOr نزدیکترین همسایه
KNN یک الگوریتم ساده است که تمام موارد موجود را ردیابی میکند و موارد جدید بر اساس توابع فاصله طبقهبندی میشوند [30]. KNN در تشخیص الگو و تخمین آماری به عنوان یک روش ناپارامتریک استفاده شده است. رأی اکثریت همسایهها برای طبقهبندی یک مورد، در نظر گرفته میشود و با اندازهگیری تابع فاصله یک کلاس به یک مورد اختصاص مییابد. مزایای KNN شامل این موارد است: 1. اجرای آن آسان و ساده است. 2. الگوریتم را میتوان برای جستوجو، رگرسیون و همچنین طبقهبندی استفاده کرد. 3. نیازی به تنظیم پارامترها، ایجاد فرضیات اضافی یا ساخت مدل نیست. نقطه ضعف الگوریتم این است که با افزایش تعداد متغیرهای مستقل یا پیشبینیکنندهها، عملکرد الگوریتم به طور قابل توجهی کاهش مییابد.
جنگل تصادفی
تفسیرپذیری درختان تصمیم و دوره منطقی آموزش آنها همواره توجه محققان را به خود جلب کرده است، اما یکی از مشکلات این روشها همیشه برازش بیش از حد بوده است. جنگل تصادفی یکی از روشهایی است که برای حل مشکل برازش بیش از حد در DTها معرفی شده است. به دلیل دقت بالا، سرعت یادگیری مناسب و توانایی تفکیک دادهها در فضاهای با ابعاد بالا، به سرعت جایگاه خود را در بین محققان پیدا کرد. با آموزش چندین درخت تصمیمگیری مختلف و رأی دادن در میان آنها، این مدلها در برابر نویزها و دادههای پرت میتوانند قویتر باشند [31].
پارامترهای آماری
نتایج طبقهبندی با استفاده از روش اعتبارسنجی متقاطع دهبرابری ارزیابی میشود. عملکرد الگوریتم با استفاده از معیارهای ارزیابی مانند اختصاصیت، حساسیت، دقت و F1-ScOre (F-S) برآورد شد. این اصطلاحات از ماتریس درهمریختگی استخراج میشوند: مثبت درست، منفی غلط، منفی درست و مثبت غلط (فرمولهای شماره 33 تا 37) [22].
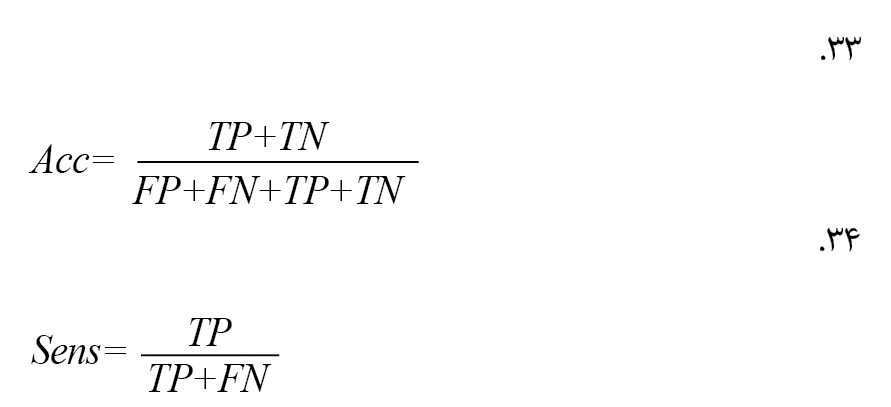

یافتهها
نتایج روش پیشنهادی در این بخش ارائه شده است. به منظور پیادهسازی روش پیشنهادی، از سیستمی مجهز به رم 16 گیگابایتی، پردازنده گرافیکی Nvidia 1070 و CPU COre i7 استفاده شده است. MATLAB 2019a برای اجرای بخشهای پیشپردازش و استخراج ویژگی استفاده شده است. همچنین، روش AE و تکنیکهای طبقهبندی با استفاده از جعبه ابزار پایتون، کراس و Sk-learn پیادهسازی شده است [32, 33].
در روش پیشنهادی، از مجموعه داده بن برای تشخیص تشنج صرع استفاده شده است. همانطور که در جدول شماره 2 نشان داده شده است، از شش مسئله طبقهبندی مختلف استفاده کردهایم. ابتدا، سیگنالهای الکتروانسفالوگرافی مجموعه داده بن به پنجرههای زمانی پنجثانیهای تجزیه میشوند. در ادامه، تبدیل موجک عامل Q قابل تنظیم برای تجزیه سیگنالهای الکتروانسفالوگرافی به زیرباندهای فرکانسی مختلف استفاده شده است. در ادامه، ویژگیهای مختلف آماری و غیرخطی از زیرباندهای تبدیل موجک عامل Q قابل تنظیم استخراج شده است. در این بخش تعداد 153 ویژگی از زیرباندهای موجک استخراج شده است. در مرحله بعد از روش AE و تعداد لایههای پیشنهادی برای کاهش ویژگی استفاده شده است. با استفاده از روش AE، تعداد ویژگیها به x کاهش یافت. درنهایت الگوریتمهای مختلفی برای طبقهبندی استفاده شده است.
هنگامی که از الگوریتمهای بهینهسازی در یادگیری ماشینی (از جمله طبقهبندی دادههای پزشکی) استفاده میشود، محققان اغلب روش پیشنهادی را چندین بار در شرایط یکسان برای به دست آوردن نتایج معتبر انجام میدهند. بدین منظور در بخش تجربی، تمامی الگوریتمهای طبقهبندی را ده بار در شرایط مشابه انجام دادهایم تا نتایج معتبری به دست آوریم. نتایج هر الگوریتم طبقهبندی برای حالتهای طبقهبندی مختلف در جدول شماره 4 نشان داده شده است.
.jpg)
با توجه به جدول شماره 4، روش SVM-GOA توانسته است به دقت بالاتری نسبت به سایر الگوریتمهای طبقهبندیکننده دست یابد.
بحث
صرع به عنوان یک فعالیت غیرطبیعی در مغز که به عنوان یک اختلال عصبی شناخته میشود و باعث تشنج یا دورههای رفتار غیرطبیعی، احساسات و گاهی اوقات بیهوشی میشود در نظر گرفته میشود [1, 2, 3, 4]. یکی از متداولترین روشهای تصویربرداری عصبی عملکردی در تشخیص اپیزودهای صرع، ثبت سیگنالهای الکتروانسفالوگرافی است. سیگنالهای الکتروانسفالوگرافی میتواند محل دقیق صرع را مشخص کند و ثبت آن نسبت به سایر روشهای تصویربرداری عصبی هزینه کمتری دارد [1, 2, 3, 4]. علاوه بر این، سیگنالهای الکتروانسفالوگرافی با وجود مزایایی که دارند، چالشهای مختلفی را برای پزشکان ایجاد میکنند. ثبت سیگنالهای الکتروانسفالوگرافی بیماران به روشی طولانیمدت برای تشخیص تشنجهای صرع انجام میشود که پزشکان را در مکانیابی دقیق بیماری به چالش میکشد. تشخیص تشنجهای صرع دشوار است، زیرا قرائتهای سیگنالهای الکتروانسفالوگرافی اغلب حاوی انواع ناهنجاریهای داخلی و خارجی هستند. بنابراین یک روش جدید برای تشخیص تشنج صرع در این مطالعه بر اساس تکنیکهای ML و DL برای غلبه بر این چالشها ارائه شده است.
نتیجهگیری
پیشپردازش تبدیل موجک عامل Q قابل تنظیم، استخراج ویژگیهای آماری و غیرخطی، کاهش ویژگی AE و طبقهبندی SVM-GOA در این مطالعه برای تشخیص تشنجهای صرع از سیگنالهای الکتروانسفالوگرافی استفاده میشوند. در مرحله اول از پایگاه داده بن برای پیادهسازی روش پیشنهادی استفاده میشود. سپس سیگنالهای الکتروانسفالوگرافی در بخش پیشپردازش به فواصل پنجثانیهای تقسیم میشوند و از تبدیل موجک عامل Q قابل تنظیم برای تجزیهوتحلیل آنها به زیرباندهای خود استفاده میشود که پارامترهای آنها در Q=1 ،r=3 وJ=8 تنظیم شده است. مرتبطترین ویژگیهای آماری و غیرخطی از هر زیرباند تبدیل موجک عامل Q قابل تنظیم در مرحله استخراج ویژگی بازیابی میشوند. سیگنالهای الکتروانسفالوگرافی رفتار آشفتهای دارند و اتخاذ ویژگیهای توصیفشده در این مطالعه، دقت تشخیص تشنجهای صرعی را بهبود بخشیده است. در مرحله کاهش ویژگی از روش AE مبتنی بر DL استفاده شده است که برای اولین بار توسط این مقاله با تعداد لایههای پیشنهادی به عنوان اولین نوآوری این مطالعه ارائه شده است. درنهایت از روشهای مختلف ML در مرحله طبقهبندی برای انجام مقایسهها استفاده شد. استفاده از روش طبقهبندی SVM-GOA نوآوری این بخش است که توسط محققین ارائه شده است. جدول شماره 5 نتایج روش پیشنهادی را با روشهای دیگر با استفاده از سیگنالهای سیگنالهای الکتروانسفالوگرافی برای تشخیص تشنج صرع مقایسه میکند.
.jpg)
با توجه به جدول شماره 5، نتایج روش پیشنهادی به دلیل روشهای پیشپردازش مناسب، استخراج ویژگی، انتخاب ویژگی و طبقهبندی، دقیقتر از سایر مطالعات است. روش پیشنهادی را میتوان بر روی یک پلتفرم سختافزاری یا نرمافزاری برای کمک به پزشکان در تشخیص تشنجهای صرع پیادهسازی کرد. تحقیقات آینده میتواند بر روی تکنیکهای جدید DL، مانند یادگیری توجه، نمودار، و یادگیری q و غیره برای تشخیص تشنجهای صرع با استفاده از سیگنالهای الکتروانسفالوگرافی تمرکز کند [56, 57, 58, 59, 60]. تکنیکهای همجوشی ویژگی عمیق را نیز میتوان در مطالعات آینده مورد بررسی قرار داد و ترکیبی از ویژگیهای دستساز را میتوان همراه با تکنیکهای DL برای تشخیص تشنجهای صرعی به کار برد [61, 62, 63].
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش از یک پایاننامه استخراج شده است و نیازی به تأیید اخلاقی نبود.
حامی مالی
این مطالعه از هیچ سازمانی حمایت مالی و عملکردی دریافت نکرده است.
مشارکت نویسندگان
همه نویسندگان سهم یکسانی در تهیه این مقاله داشتند.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از همکاری معاونت پژوهشی دانشگاه آزاد اسلامی واحد گناباد تشکر و قدردانی میکنند.
نیروی گرانش روی ملخ iام به صورت فرمول شماره 27 تعریف میشود.
27.
Gi=-geg
به طوری که g نیروی گرانش است و eg نشاندهنده یک بردار واحد به سمت مرکز زمین است.
فرارفت باد روی ملخ iام به صورت فرمول شماره 28 محاسبه میشود[21].
28.
Ai=-uew
که u رانش ثابت و ew بردار واحد باد است. حال با توجه به تعاریف بهکاررفته، فرمول شماره 29 ارائه میشود [21].

معادله مذکور را نمیتوان به عنوان یک مسئله بهینهسازی استفاده کرد، زیرا الگوریتم را از کاوش و بهرهبرداری مناسب در فضای جستوجو در اطراف یک راه حل منع میکند. دلیل دوم این است که این معادله برای مدلسازی فضای باز است. برای اصلاح معادله مذکور و ارائه یک مدل عملکردی از الگوریتم GOA برای بهروزرسانی مکان هر ملخ، آن را به صورت زیر بازنویسی میکنیم (فرمول شماره 30) [21].
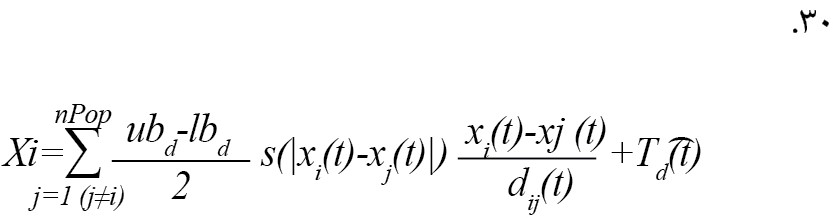
در معادله مذکور، پارامترهای جدید به صورت زیر بیان میشوند [21]:
ubd :کران بالایی در بعد Dام، lbd کران پایینی در بعد Dام است [21].
Td (d): مقدار بهترین راهحل بهدستآمده (تا تکرار tام) در بعد Dام و همچنین c به عنوان ضریب کاهشی در نظر گرفته میشود [21].
فرمول شماره 31 موقعیت بعدی ملخ بیان میکند [21].
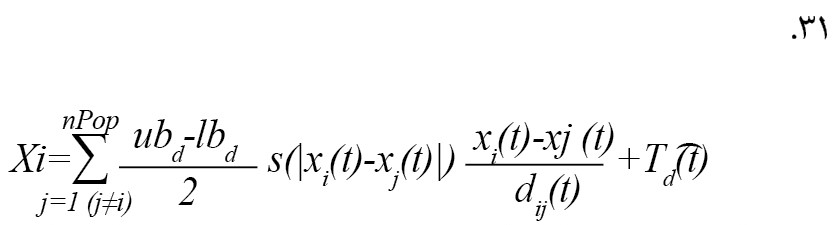
در معادله مذکور، xid (t+1) موقعیت بعدی ملخ i، x_i (t) موقعیت فعلی ملخ i، xj (t) موقعیت همه ملخهای دیگر و درنهایت Td (t) موقعیت هدف است [21].
بحث بعدی در مورد پارامتر c است. بهروزرسانی پارامتر c با فرمول شماره 32 انجام میشود [21].

در این معادله، cmax به عنوان حداکثر مقدار C (معمولاً نزدیک به 1)، cmin حداقل مقدار C (معمولاً نزدیک به صفر مثبت)، t تکرار فعلی و درنهایت، tMax حداکثر تکرار است. پارامتر مقایسهای c دو بار در این فرمول به دست میآید که دلایل آن به صورت زیر توضیح داده شده است [21].
c اول: بین اکتشاف و بهرهبرداری تعادل برقرار میکند. این c شباهت زیادی به پارامتر w در الگوریتم بهینهسازی PSO دارد [21].
c دوم: منطقه جذب، منطقه آسایش و منطقه دافعه بین ملخها را کاهش میدهد [57] (فرمول شماره 33).
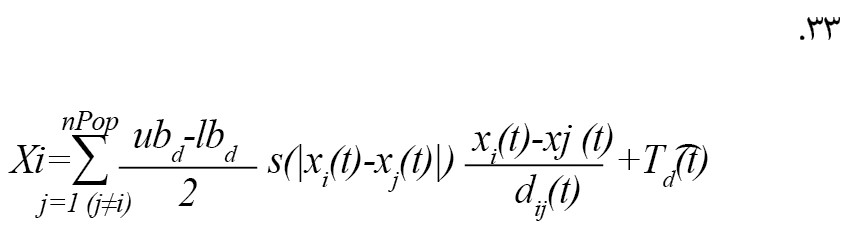
K- Nearest NeighbOr نزدیکترین همسایه
KNN یک الگوریتم ساده است که تمام موارد موجود را ردیابی میکند و موارد جدید بر اساس توابع فاصله طبقهبندی میشوند [30]. KNN در تشخیص الگو و تخمین آماری به عنوان یک روش ناپارامتریک استفاده شده است. رأی اکثریت همسایهها برای طبقهبندی یک مورد، در نظر گرفته میشود و با اندازهگیری تابع فاصله یک کلاس به یک مورد اختصاص مییابد. مزایای KNN شامل این موارد است: 1. اجرای آن آسان و ساده است. 2. الگوریتم را میتوان برای جستوجو، رگرسیون و همچنین طبقهبندی استفاده کرد. 3. نیازی به تنظیم پارامترها، ایجاد فرضیات اضافی یا ساخت مدل نیست. نقطه ضعف الگوریتم این است که با افزایش تعداد متغیرهای مستقل یا پیشبینیکنندهها، عملکرد الگوریتم به طور قابل توجهی کاهش مییابد.
جنگل تصادفی
تفسیرپذیری درختان تصمیم و دوره منطقی آموزش آنها همواره توجه محققان را به خود جلب کرده است، اما یکی از مشکلات این روشها همیشه برازش بیش از حد بوده است. جنگل تصادفی یکی از روشهایی است که برای حل مشکل برازش بیش از حد در DTها معرفی شده است. به دلیل دقت بالا، سرعت یادگیری مناسب و توانایی تفکیک دادهها در فضاهای با ابعاد بالا، به سرعت جایگاه خود را در بین محققان پیدا کرد. با آموزش چندین درخت تصمیمگیری مختلف و رأی دادن در میان آنها، این مدلها در برابر نویزها و دادههای پرت میتوانند قویتر باشند [31].
پارامترهای آماری
نتایج طبقهبندی با استفاده از روش اعتبارسنجی متقاطع دهبرابری ارزیابی میشود. عملکرد الگوریتم با استفاده از معیارهای ارزیابی مانند اختصاصیت، حساسیت، دقت و F1-ScOre (F-S) برآورد شد. این اصطلاحات از ماتریس درهمریختگی استخراج میشوند: مثبت درست، منفی غلط، منفی درست و مثبت غلط (فرمولهای شماره 33 تا 37) [22].
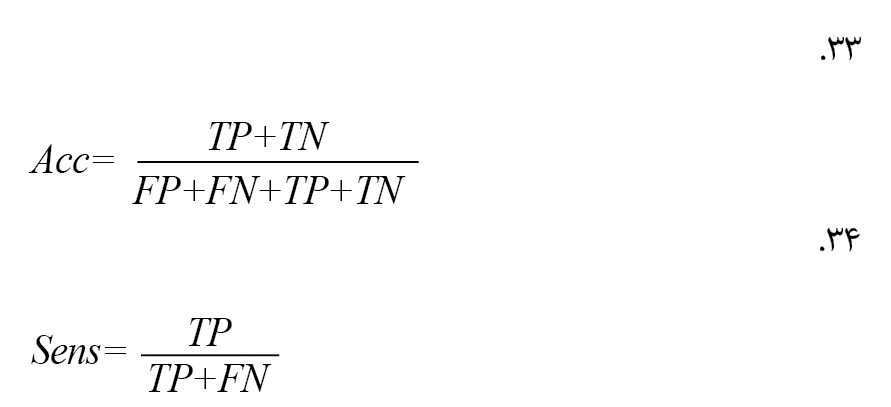

یافتهها
نتایج روش پیشنهادی در این بخش ارائه شده است. به منظور پیادهسازی روش پیشنهادی، از سیستمی مجهز به رم 16 گیگابایتی، پردازنده گرافیکی Nvidia 1070 و CPU COre i7 استفاده شده است. MATLAB 2019a برای اجرای بخشهای پیشپردازش و استخراج ویژگی استفاده شده است. همچنین، روش AE و تکنیکهای طبقهبندی با استفاده از جعبه ابزار پایتون، کراس و Sk-learn پیادهسازی شده است [32, 33].
در روش پیشنهادی، از مجموعه داده بن برای تشخیص تشنج صرع استفاده شده است. همانطور که در جدول شماره 2 نشان داده شده است، از شش مسئله طبقهبندی مختلف استفاده کردهایم. ابتدا، سیگنالهای الکتروانسفالوگرافی مجموعه داده بن به پنجرههای زمانی پنجثانیهای تجزیه میشوند. در ادامه، تبدیل موجک عامل Q قابل تنظیم برای تجزیه سیگنالهای الکتروانسفالوگرافی به زیرباندهای فرکانسی مختلف استفاده شده است. در ادامه، ویژگیهای مختلف آماری و غیرخطی از زیرباندهای تبدیل موجک عامل Q قابل تنظیم استخراج شده است. در این بخش تعداد 153 ویژگی از زیرباندهای موجک استخراج شده است. در مرحله بعد از روش AE و تعداد لایههای پیشنهادی برای کاهش ویژگی استفاده شده است. با استفاده از روش AE، تعداد ویژگیها به x کاهش یافت. درنهایت الگوریتمهای مختلفی برای طبقهبندی استفاده شده است.
هنگامی که از الگوریتمهای بهینهسازی در یادگیری ماشینی (از جمله طبقهبندی دادههای پزشکی) استفاده میشود، محققان اغلب روش پیشنهادی را چندین بار در شرایط یکسان برای به دست آوردن نتایج معتبر انجام میدهند. بدین منظور در بخش تجربی، تمامی الگوریتمهای طبقهبندی را ده بار در شرایط مشابه انجام دادهایم تا نتایج معتبری به دست آوریم. نتایج هر الگوریتم طبقهبندی برای حالتهای طبقهبندی مختلف در جدول شماره 4 نشان داده شده است.
.jpg)
با توجه به جدول شماره 4، روش SVM-GOA توانسته است به دقت بالاتری نسبت به سایر الگوریتمهای طبقهبندیکننده دست یابد.
بحث
صرع به عنوان یک فعالیت غیرطبیعی در مغز که به عنوان یک اختلال عصبی شناخته میشود و باعث تشنج یا دورههای رفتار غیرطبیعی، احساسات و گاهی اوقات بیهوشی میشود در نظر گرفته میشود [1, 2, 3, 4]. یکی از متداولترین روشهای تصویربرداری عصبی عملکردی در تشخیص اپیزودهای صرع، ثبت سیگنالهای الکتروانسفالوگرافی است. سیگنالهای الکتروانسفالوگرافی میتواند محل دقیق صرع را مشخص کند و ثبت آن نسبت به سایر روشهای تصویربرداری عصبی هزینه کمتری دارد [1, 2, 3, 4]. علاوه بر این، سیگنالهای الکتروانسفالوگرافی با وجود مزایایی که دارند، چالشهای مختلفی را برای پزشکان ایجاد میکنند. ثبت سیگنالهای الکتروانسفالوگرافی بیماران به روشی طولانیمدت برای تشخیص تشنجهای صرع انجام میشود که پزشکان را در مکانیابی دقیق بیماری به چالش میکشد. تشخیص تشنجهای صرع دشوار است، زیرا قرائتهای سیگنالهای الکتروانسفالوگرافی اغلب حاوی انواع ناهنجاریهای داخلی و خارجی هستند. بنابراین یک روش جدید برای تشخیص تشنج صرع در این مطالعه بر اساس تکنیکهای ML و DL برای غلبه بر این چالشها ارائه شده است.
نتیجهگیری
پیشپردازش تبدیل موجک عامل Q قابل تنظیم، استخراج ویژگیهای آماری و غیرخطی، کاهش ویژگی AE و طبقهبندی SVM-GOA در این مطالعه برای تشخیص تشنجهای صرع از سیگنالهای الکتروانسفالوگرافی استفاده میشوند. در مرحله اول از پایگاه داده بن برای پیادهسازی روش پیشنهادی استفاده میشود. سپس سیگنالهای الکتروانسفالوگرافی در بخش پیشپردازش به فواصل پنجثانیهای تقسیم میشوند و از تبدیل موجک عامل Q قابل تنظیم برای تجزیهوتحلیل آنها به زیرباندهای خود استفاده میشود که پارامترهای آنها در Q=1 ،r=3 وJ=8 تنظیم شده است. مرتبطترین ویژگیهای آماری و غیرخطی از هر زیرباند تبدیل موجک عامل Q قابل تنظیم در مرحله استخراج ویژگی بازیابی میشوند. سیگنالهای الکتروانسفالوگرافی رفتار آشفتهای دارند و اتخاذ ویژگیهای توصیفشده در این مطالعه، دقت تشخیص تشنجهای صرعی را بهبود بخشیده است. در مرحله کاهش ویژگی از روش AE مبتنی بر DL استفاده شده است که برای اولین بار توسط این مقاله با تعداد لایههای پیشنهادی به عنوان اولین نوآوری این مطالعه ارائه شده است. درنهایت از روشهای مختلف ML در مرحله طبقهبندی برای انجام مقایسهها استفاده شد. استفاده از روش طبقهبندی SVM-GOA نوآوری این بخش است که توسط محققین ارائه شده است. جدول شماره 5 نتایج روش پیشنهادی را با روشهای دیگر با استفاده از سیگنالهای سیگنالهای الکتروانسفالوگرافی برای تشخیص تشنج صرع مقایسه میکند.
.jpg)
با توجه به جدول شماره 5، نتایج روش پیشنهادی به دلیل روشهای پیشپردازش مناسب، استخراج ویژگی، انتخاب ویژگی و طبقهبندی، دقیقتر از سایر مطالعات است. روش پیشنهادی را میتوان بر روی یک پلتفرم سختافزاری یا نرمافزاری برای کمک به پزشکان در تشخیص تشنجهای صرع پیادهسازی کرد. تحقیقات آینده میتواند بر روی تکنیکهای جدید DL، مانند یادگیری توجه، نمودار، و یادگیری q و غیره برای تشخیص تشنجهای صرع با استفاده از سیگنالهای الکتروانسفالوگرافی تمرکز کند [56, 57, 58, 59, 60]. تکنیکهای همجوشی ویژگی عمیق را نیز میتوان در مطالعات آینده مورد بررسی قرار داد و ترکیبی از ویژگیهای دستساز را میتوان همراه با تکنیکهای DL برای تشخیص تشنجهای صرعی به کار برد [61, 62, 63].
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش از یک پایاننامه استخراج شده است و نیازی به تأیید اخلاقی نبود.
حامی مالی
این مطالعه از هیچ سازمانی حمایت مالی و عملکردی دریافت نکرده است.
مشارکت نویسندگان
همه نویسندگان سهم یکسانی در تهیه این مقاله داشتند.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از همکاری معاونت پژوهشی دانشگاه آزاد اسلامی واحد گناباد تشکر و قدردانی میکنند.
References
1.Shoeibi A, Khodatars M, Ghassemi N, Jafari M, Moridian P, Alizadehsani R, et al. Epileptic seizures detection using deep learning techniques: A review. International Journal of Environmental Research and Public Health. 2021; 18(11):5780. [DOI:10.3390/ijerph18115780] [PMID] [PMCID]
2.Shoeibi A, Ghassemi N, Khodatars M, Jafari M, Moridian P, Alizadehsani R, et al. Applications of epileptic seizures detection in neuroimaging modalities using deep learning techniques: Methods, challenges, and future works. arXiv preprint arXiv:2105.14278. 2021. https://arxiv.org/pdf/2105.14278.pdf
3.Subasi A. Epileptic seizure detection using dynamic wavelet network. Expert Systems with Applications. 2005; 29(2):343-55. [DOI:10.1016/j.eswa.2005.04.007]
4.Subasi A, Erçelebi E, Alkan A, Koklukaya E. Comparison of subspace-based methods with AR parametric methods in epileptic seizure detection. Computers in Biology and Medicine. 2006; 36(2):195-208. [DOI:10.1016/j.compbiomed.2004.11.001] [PMID]
5.Alizadehsani R, Roshanzamir M, Hussain S, Khosravi A, Koohestani A, Zangooei MH, et al. Handling of uncertainty in medical data using machine learning and probability theory techniques: A review of 30 years (1991–2020). Annals of Operations Research. 2021:1-42. [DOI:10.1007/s10479-021-04006-2] [PMID] [PMCID]
6.Siddiqui MK, Morales-Menendez R, Huang X, Hussain N. A review of epileptic seizure detection using machine learning classifiers. Brain Informatics. 2020; 7(1):5. [DOI:10.1186/s40708-020-00105-1] [PMID] [PMCID]
7.Piccialli F, Di Somma V, Giampaolo F, Cuomo S, Fortino G. A survey on deep learning in medicine: Why, how and when? Information Fusion. 2021; 66:111-37. [DOI:10.1016/j.inffus.2020.09.006]
8.Akay A, Hess H. Deep learning: Current and emerging applications in medicine and technology. IEEE Journal of Biomedical and Health Informatics. 2019; 23(3):906-20. [DOI:10.1109/JBHI.2019.2894713] [PMID]
9.Srinivasan V, Eswaran C, Sriraam N. Artificial neural network based epileptic detection using time-domain and frequency-domain features. Journal of Medical Systems. 2005; 29(6):647-60. [DOI:10.1007/s10916-005-6133-1] [PMID]
10.Faust O, Acharya UR, Min LC, Sputh BH. Automatic identification of epileptic and background EEG signals using frequency domain parameters. International Journal of Neural Systems. 2010; 20(2):159-76. [DOI:10.1142/S0129065710002334] [PMID]
11.Li M, Sun X, Chen W, Jiang Y, Zhang T. Classification epileptic seizures in EEG using time-frequency image and block texture features. IEEE Access. 2019; 8:9770-81. [DOI:10.1109/ACCESS.2019.2960848]
12.Yuan Q, Zhou W, Liu Y, Wang J. Epileptic seizure detection with linear and nonlinear features. Epilepsy & Behavior. 2012; 24(4):415-21. [DOI:10.1016/j.yebeh.2012.05.009] [PMID]
13.Goodfellow I, Bengio Y, Courville A. Deep learning. United States: MIT press; 2016. https://books.google.com/books/about/Deep_Learning.html?id=Np9SDQAAQBAJ
14.Emami A, Kunii N, Matsuo T, Shinozaki T, Kawai K, Takahashi H. Autoencoding of long-term scalp electroencephalogram to detect epileptic seizure for diagnosis support system. Computers in Biology and Medicine. 2019; 110:227-33. [DOI:10.1016/j.compbiomed.2019.05.025] [PMID]
15.Jaafar ST, Mohammadi M. Epileptic seizure detection using deep learning approach. UHD Journal of Science and Technology. 2019; 3(2):41-50. [DOI:10.21928/uhdjst.v3n2y2019.pp41-50]
16.Shahbazi M, Aghajan H. A generalizable model for seizure prediction based on deep learning using CNN-LSTM architecture. IEEE Global Conference on Signal and Information Processing (GlobalSIP), 2018 Nov 26, Anaheim, CA, USA. [DOI:10.1109/GlobalSIP.2018.8646505]
17.Truong ND, Kavehei O. Low precision electroencephalogram for seizure detection with convolutional neural network. IEEE International Conference on Artificial Intelligence Circuits and Systems (AICAS), 2019 Mar 18, Taiwan. [DOI:10.1109/AICAS.2019.8771569]
18.Zhou M, Tian C, Cao R, Wang B, Niu Y, Hu T, et al. Epileptic seizure detection based on EEG signals and CNN. Frontiers in Neuroinformatics. 2018; 12:95. [DOI:10.3389/fninf.2018.00095] [PMID] [PMCID]
19.Movahedi F, Coyle JL, Sejdić E. Deep belief networks for electroencephalography: A review of recent contributions and future outlooks. IEEE Journal of Biomedical and Health Informatics. 2017; 22(3):642-52. [DOI:10.1109/JBHI.2017.2727218] [PMID] [PMCID]
20.Selesnick IW. Wavelet transform with tunable Q-factor. IEEE Transactions on Signal Processing. 2011; 59(8):3560-75. [DOI:10.1109/TSP.2011.2143711]
21.Abualigah L, Diabat A. A comprehensive survey of the Grasshopper optimization algorithm: Results, variants, and applications. Neural Computing and Applications. 2020; 32(19):15533-56. [DOI:10.1007/s00521-020-04789-8].
22.Department of Epileptology University of Bonn. EEG time series data. Bonn: Department of Epileptology University of Bonn, Germany; 2015. http://epileptologie-bonn.de/cms/front_content.php?idcat=193&lang=3&changelang=3 [accessed September, 2015]
23.Sameer M, Gupta B. Detection of epileptical seizures based on alpha band statistical features. Wireless Personal Communications. 2020; 115(2):909-25. [DOI:10.1007/s11277-020-07852-8]
24.Esteller R, Vachtsevanos G, Echauz J, Litt B. A comparison of waveform fractal dimension algorithms. IEEE Transactions on Circuits and Systems I: Fundamental Theory and Applications. 2001; 48(2):177-83. [DOI:10.1109/81.904882]
25.Madan S, Srivastava K, Sharmila A, Mahalakshmi P. A case study on Discrete Wavelet Transform based Hurst exponent for epilepsy detection. Journal of Medical Engineering & Technology. 2018; 42(1):9-17. [DOI:10.1080/03091902.2017.1394390] [PMID]
26.Acharya UR, Hagiwara Y, Koh JE, Oh SL, Tan JH, Adam M, et al. Entropies for automated detection of coronary artery disease using ECG signals: A review. Biocybernetics and Biomedical Engineering. 2018; 38(2):373-84. [DOI:10.1016/j.bbe.2018.03.001]
27.Mohammadpoory Z, Nasrolahzadeh M, Haddadnia J. Epileptic seizure detection in EEGs signals based on the weighted visibility graph entropy. Seizure. 2017; 50:202-8. [DOI:10.1016/j.seizure.2017.07.001] [PMID]
28.Wang Y, Yao H, Zhao S. Auto-encoder based dimensionality reduction. Neurocomputing. 2016; 184:232-42. [DOI:10.1016/j.neucom.2015.08.104]
29.William SN, Teukolsky SA. What is a support vector machine. Nat Biotechnol. 2006; 24(12):1565-7. [DOI:10.1038/nbt1206-1565] [PMID]
30.Keller JM, Gray MR, Givens JA. A fuzzy k-nearest neighbor algorithm. IEEE Transactions on Systems, Man, and Cybernetics. 1985; 15(4):258-63. [DOI:10.1109/TSMC.1985.6313426]
31.Oshiro TM, Perez PS, Baranauskas JA. How many trees in a random forest? International workshop on machine learning and data mining in pattern recognition. Berlin, Heidelberg: Springer; 2012. [DOI:10.1007/978-3-642-31537-4_13]
32.Ketkar N. Introduction to GPUs. Deep learning with Python. 1th ed. Berkeley, CA: Apress; 2017. [DOI:10.1007/978-1-4842-2766-4_10]
33.Pedregosa F, Varoquaux G, Gramfort A, Michel V, Thirion B, Grisel O, et al. Scikit-learn: Machine learning in Python. The Journal of Machine Learning Research. 2011; 12:2825-30. https://www.jmlr.org/papers/volume12/pedregosa11a/pedregosa11a.pdf?ref=https://githubhelp.com
34.Ghassemi N, Shoeibi A, Rouhani M, Hosseini-Nejad H. Epileptic seizures detection in EEG signals using TQWT and ensemble learning. 9th International Conference on Computer and Knowledge Engineering (ICCKE), 2019 Oct 24, Mashhad, Iran. [DOI:10.1109/ICCKE48569.2019.8964826]
35.Nishad A, Pachori RB. Classification of epileptic electroencephalogram signals using tunable-Q wavelet transform based filter-bank. Journal of Ambient Intelligence and Humanized Computing. 2020. [DOI:10.1007/s12652-020-01722-8]
36.Sharaf AI, El-Soud MA, El-Henawy IM. An automated approach for epilepsy detection based on tunable Q-wavelet and firefly feature selection algorithm. International Journal of Biomedical Imaging. 2018; 2018:5812872. [DOI:10.1155/2018/5812872] [PMID] [PMCID]
37.Gupta V, Bhattacharyya A, Pachori RB. Classification of seizure and non-seizure EEG signals based on EMD-TQWT method. 22nd International Conference on Digital Signal Processing (DSP), 2017 Aug 23, London, United Kingdom. [DOI:10.1109/ICDSP.2017.8096036]
38.Reddy GR, Rao R. Automated identification system for seizure EEG signals using tunable-Q wavelet transform. Engineering Science and Technology, an International Journal. 2017; 20(5):1486-93. [DOI:10.1016/j.jestch.2017.11.003]
39.Ramos-Aguilar R, Olvera-López JA, Olmos-Pineda I, Sánchez-Urrieta S. Feature extraction from EEG spectrograms for epileptic seizure detection. Pattern Recognition Letters. 2020; 133:202-9. [DOI:10.1016/j.patrec.2020.03.006]
40.Chen S, Zhang X, Chen L, Yang Z. Automatic diagnosis of epileptic seizure in electroencephalography signals using nonlinear dynamics features. IEEE Access. 2019; 7:61046-56. [DOI:10.1109/ACCESS.2019.2915610]
41.Tuncer T, Dogan S, Akbal E. A novel local senary pattern based epilepsy diagnosis system using EEG signals. Australasian Physical & Engineering Sciences in Medicine. 2019; 42(4):939-48. [DOI:10.1007/s13246-019-00794-x] [PMID]
42.Gupta V, Pachori RB. Epileptic seizure identification using entropy of FBSE based EEG rhythms. Biomedical Signal Processing and Control. 2019; 53:101569. [DOI:10.1016/j.bspc.2019.101569]
43.Raghu S, Sriraam N, Hegde AS, Kubben PL. A novel approach for classification of epileptic seizures using matrix determinant. Expert Systems with Applications. 2019; 127:323-41. [DOI:10.1016/j.eswa.2019.03.021]
44.Sharma S, Bhatia V, Gupta A. Noncoherent IR-UWB receiver using massive antenna arrays for wireless sensor networks. IEEE Sensors Letters. 2017; 2(1):1-4. [DOI:10.1109/LSENS.2017.2778430]
45.Abedin MZ, Akther S, Hossain MS. An artificial neural network model for epilepsy seizure detection. 5th International Conference on Advances in Electrical Engineering (ICAEE) 2019 Sep 26, Dhaka, Bangladesh. [DOI:10.1109/ICAEE48663.2019.8975569]
46.Tzimourta KD, Tzallas AT, Giannakeas N, Astrakas LG, Tsalikakis DG, Angelidis P, et al. A robust methodology for classification of epileptic seizures in EEG signals. Health and Technology. 2019; 9(2):135-42. [DOI:10.1007/s12553-018-0265-z]
47.Singh G, Kaur M, Singh B. Detection of epileptic seizure EEG signal using multiscale entropies and complete ensemble empirical mode decomposition. Wireless Personal Communications. 2021; 116(1):845-64. [DOI:10.1007/s11277-020-07742-z]
48.Liu Y, Jiang B, Feng J, Hu J, Zhang H. Classification of EEG signals for epileptic seizures using feature dimension reduction algorithm based on LPP. Multimedia Tools and Applications. 2021; 80(20):30261-82. [DOI:10.1007/s11042-020-09135-7]
49.Aliyu I, Lim CG. Selection of optimal wavelet features for epileptic EEG signal classification with LSTM. Neural Computing and Applications. 2021. [DOI:10.1007/s00521-020-05666-0]
50.Sameer M, Gupta B. Beta band as a biomarker for classification between interictal and ictal states of epileptical patients. 7th International Conference on Signal Processing and Integrated Networks (SPIN), 2020 Feb 27, Noida, India. [DOI:10.1109/SPIN48934.2020.9071343]
51.Qureshi MB, Afzaal M, Qureshi MS, Fayaz M. Machine learning-based EEG signals classification model for epileptic seizure detection. Multimedia Tools and Applications. 2021; 80(12):17849-77. [DOI:10.1007/s11042-021-10597-6]
52.Al-Hadeethi H, Abdulla S, Diykh M, Deo RC, Green JH. Adaptive boost LS-SVM classification approach for time-series signal classification in epileptic seizure diagnosis applications. Expert Systems with Applications. 2020; 161:113676. [DOI:10.1016/j.eswa.2020.113676
53.Whitley D. A genetic algorithm tutorial. Statistics and Computing. 1994; 4(2):65-85. [DOI:10.1007/BF00175354]
54.Zhou C, Gao HB, Gao L, Zhang WG. Particle swarm optimization (PSO)algorithm. Application Research of Computers. 2003; 12:7-11
55.Settles M, Soule T. Breeding swarms: A GA/PSO hybrid. 7th annual conference on genetic and evolutionary computation, 2005 Jun 25, New York, United States. [DOI:10.1145/1068009.1068035
56.Khodatars M, Shoeibi A, Sadeghi D, Ghassemi N, Jafari M, Moridian P, et al. Deep learning for neuroimaging-based diagnosis and rehabilitation of autism spectrum disorder: A review. Computers in Biology and Medicine. 2021; 139:104949 [DOI:10.1016/j.compbiomed.2021.104949] [PMID]
57.Shoeibi A, Sadeghi D, Moridian P, Ghassemi N, Heras J, Alizadehsani R, et al. Automatic diagnosis of schizophrenia using EEG signals and CNN-LSTM models. Frontiers in Neuroinformatics. 2021; 15:777977 [DOI:10.3389/fninf.2021.777977] [PMID] [PMCID]
58.Shoeibi A, Khodatars M, Jafari M, Moridian P, Rezaei M, Alizadehsani R, et al. Applications of deep learning techniques for automated multiple sclerosis detection using magnetic resonance imaging: A review. Computers in Biology and Medicine. 2021; 136:104697. [DOI:10.1016/j.compbiomed.2021.104697] [PMID]
59.Sadeghi D, Shoeibi A, Ghassemi N, Moridian P, Khadem A, Alizadehsani R, et al. An overview on artificial intelligence techniques for diagnosis of schizophrenia based on magnetic resonance imaging modalities: Methods, challenges, and future works. arXiv preprint arXiv:2103.03081. 2021. https://arxiv.org/abs/2103.03081
60.Alizadehsani R, Sharifrazi D, Izadi NH, Joloudari JH, Shoeibi A, Gorriz JM, et al. Uncertainty-aware semi-supervised method using large unlabeled and limited labeled COVID-19 data. ACM Transactions on Multimedia Computing, Communications, and Applications. 2021; 17(3s):1-24. [DOI:10.1145/3462635]
61.Yang J, Yao S, Wang J. Deep fusion feature learning network for MI-EEG classification. IEEE Access. 2018; 6:79050-9. [DOI:10.1109/ACCESS.2018.2877452]
62.Amin SU, Alsulaiman M, Muhammad G, Mekhtiche MA, Hossain MS. Deep Learning for EEG motor imagery classification based on multi-layer CNNs feature fusion. Future Generation Computer Systems. 2019; 101:542-54. [DOI:10.1016/j.future.2019.06.027]
63.Hu D, Cao J, Lai X, Wang Y, Wang S, Ding Y. Epileptic state classification by fusing hand-crafted and deep learning EEG features. IEEE Transactions on Circuits and Systems II: Express Briefs. 2020; 68(4):1542-6. [DOI:10.1109/TCSII.2020.3031399]
نوع مطالعه: پژوهشی |
موضوع مقاله:
مطالعه بيماریها
دریافت: 1400/6/27 | پذیرش: 1400/9/13 | انتشار: 1400/10/11
دریافت: 1400/6/27 | پذیرش: 1400/9/13 | انتشار: 1400/10/11
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)