دوره 28، شماره 3 - ( تابستان 1401 )
جلد 28 شماره 3 صفحات 353-330 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Adeli H, Ahmadizadeh C, Sadeghi Zali M H. Investigation of the Effect of Lactobacillus Brevis Bacteria on the Expression of Rel A, IKB, and Casp3 Genes in HT29 Colon Cancer Cells. Intern Med Today 2022; 28 (3) :330-353
URL: http://imtj.gmu.ac.ir/article-1-3876-fa.html
URL: http://imtj.gmu.ac.ir/article-1-3876-fa.html
عادلی حجت، احمدی زاده چنگیز، صادقی زالی محمد حسین. بررسی تأثیر باکتری لاکتوباسیلوس برویس بر میزان بیان ژنهای Rel A ،IKB و Casp3 در سلولهای سرطانی کولون. طب داخلی روز. 1401; 28 (3) :330-353
1- گروه میکروبیولوژی، واحد اهر، دانشگاه آزاد اسلامی، اهر، ایران.
2- گروه میکروبیولوژی، واحد اهر، دانشگاه آزاد اسلامی، اهر، ایران. ،dr_ahmadizadeh@yahoo.com
3- گروه میکروبیولوژی، واحد ارومیه، دانشگاه آزاد اسلامی، ارومیه، ایران.
2- گروه میکروبیولوژی، واحد اهر، دانشگاه آزاد اسلامی، اهر، ایران. ،
3- گروه میکروبیولوژی، واحد ارومیه، دانشگاه آزاد اسلامی، ارومیه، ایران.
متن کامل [PDF 5671 kb]
(1092 دریافت)
| چکیده (HTML) (1549 مشاهده)
References
1.Kich DM, Vincenzi A, Majolo F, Volkende Souza CF, Goettert MI. Probiotic: Effectiveness nutrition in cancer treatment and prevention. Nutricion Hospitalaria. 2016; 33(6):1430-7. [DOI:10.20960/nh.806] [PMID]
2.Guandalini S, Cernat E, Moscoso D. Prebiotics and probiotics inirritable bowel syndromeand inflammatory bowel disease in children. Beneficial Microbes. 2015; 6(2):209-17. [DOI:10.3920/BM2014.0067] [PMID]
3.Whelan K. Probiotics and prebiotics in the management of irritable bowel syndrome: A review of recent clinical trials and systematic reviews. Current Opinion in Clinical Nutrition and Metabolic Care. 2011; 14(6):581-7 [DOI:10.1097/MCO.0b013e32834b8082] [PMID]
4.Barrons R, Tassone D. Use of Lactobacillus probiotics for bacterial genitourinary infections in women: A review. Clinical Therapeutics. 2008; 30(3):453-68. [DOI:10.1016/j.clinthera.2008.03.013] [PMID]
5.Gertler R, Rosenberg R, Schuster T, Friess H. Defining a high-risk subgroup with colon cancer stages I and II for possible adjuvant therapy. European Journal of Cancer. 2009; 45(17):2992-9. [DOI:10.1016/j.ejca.2009.07.008] [PMID]
6.Slattery ML, Curtin K, Anderson K, Ma KN, Edwards S, Leppert M, et al. Associations between dietary intake and Ki-ras mutations in colon tumors: A population-based study. Cancer Research. 2000; 60(24):6935-41. [PMID]
7.Brink M, Weijenberg MP, de Goeij AF, SchoutenLJ, Koedijk FD, Roemen GM, et al. Fat and K-ras mutations in sporadic colorectal cancer in The Netherlands Cohort Study. Carcinogenesis. 2004; 25(9):1619-28. [DOI:10.1093/carcin/bgh177] [PMID]
8.Pretlow TP, Barrow BJ, Ashton WS, O’Riordan MA, Pretlow TG, Jurcisek JA, et al. Aberrant crypts: Putative preneoplastic foci in human colonic mucosa. Cancer Research. 1991; 51(5):1564-7. [PMID]
9.Vasudevan KM, Gurumurthy S, Rangnekar VM. Suppression of PTEN expression by NF-kappa B prevents apoptosis. Molecular and Cellular Biology. 2004; 24(3):1007-21. [DOI:10.1128/MCB.24.3.1007-1021.2004] [PMID] [PMCID]
10.Buchholz TA, Garg AK, Chakravarti N, Aggarwal BB, Esteva FJ, Kuerer HM, et al. The nuclear transcription factor kappaB/bcl-2 pathway corRel Ates with pathologic complete response to doxorubicin-based neoadjuvant chemotherapy in human breast cancer. Clinical Cancer Research. 2005; 11(23):8398-402. [DOI:10.1158/1078-0432.CCR-05-0885] [PMID]
11.Rajan T, Benluvankar V, Vincent S. Saccharomyces cerevisiae-induced apoptosis of monolayer cervical cancer cells. Asian Journal of Pharmaceutical and Clinical Research. 2017; 10(8):63-66. [DOI:10.22159/ajpcr.2017.v10i8.18818]
12.Sargent DJ, Goldberg RM, Jacobson SD, Macdonald JS, Labianca R, Haller DG, et al. A pooled analysis of adjuvant chemotherapy for resected colon cancer in elderly patients. The New England Journal of Medicine. 2001; 345(15):1091-7. [DOI:10.1056/NEJMoa010957] [PMID]
13.Sevda ER, Kopara AT, Kivance M. Cytotoxic effects of various lactic acid bacteria on Caco-2 cells. Turkish Journal of Biology. 2015; 39(1):23-30. [DOI:10.3906/biy-1402-62]
14.Salminen S, Bouley C, Bourtron-Ruault MC, Cummings JH, Franck A, Gibson GR, et al. Functional food science and gastrointestinal physiology and function. The British Journal of Nutrition. 1998; 80(S1):S147-71. [DOI:10.1079/BJN19980108] [PMID]
15.Parker RB. Probiotics, the other half of the antibiotic story. Animal Nutrition & Health.1974; 29:4-8. [Link]
16.Scherezenmeir J, de Verse M. Probiotics and synbiotics approaching a definition. The American Journal of Clinical Nutrition. 2001; 73(2): 361S-64. [DOI:10.1093/ajcn/73.2.361s]
17.Wagner EF, Nebreda AR. Signal integration by JNK and p38 MAPK pathways in cancer development. Nature Reviews. Cancer. 2009; 9(8):537-49. [DOI:10.1038/nrc2694] [PMID]
18.Mumtaz PT, Bhat SA, Ahmad SM, Dar MA, Ahmed R, Urwat U, et al. LncRNAs and immunity: Watchdogs for host pathogen interactions. Biological Procedures Online. 2017; 19:3. [DOI:10.1186/s12575-017-0052-7] [PMID] [PMCID]
19.Oliver MH, Harrison NK, Bishop JE, Cole PJ, Laurent GJ. A rapid and convenient assay for counting cells cultured in microwell plates: Application for assessment of growth factors. Journal of Cell Science. 1989; 92(Pt 3):513-8. [DOI:10.1242/jcs.92.3.513] [PMID]
20.Javidnia K, Miri R, Amirghofran Z, Jafari A, Amoozegar Z . [Cytotoxic ityandanti microbial assessment of Euphoria hebecarpa (Persian)]. Iranian Journal of Pharmaceutical Research. 2004; 3(2):75-82. [Link]
21.Enoki T, Yoshida Y, Lally J, Hatta H, Bonen A.Testosterone increases lactate transport, monocarboxylate transporter (MCT) 1 and MCT4 in ratskeletal muscle. The Journal of Physiology. 2006; 577(Pt 1):433-43. [DOI:10.1113/jphysiol.2006.115436] [PMID] [PMCID]
22.Peterson SM, Freeman JL. RNA isolation from embryonic zebrafish and cDNA synthesis for gene expression analysis. Journal of Visualized Experiments. 2009; (30):1470. [DOI:10.3791/1470]
23.Daniluk U. Probiotics, the new approach for cancer prevention and/or potentialization of anti-cancer treatment. Journal of Clinical & Experimental Oncology. 2012; 1:2. [DOI:10.4172/2324-9110.1000e105]
24.de Moreno de LeBlanc A, Matar C, LeBlanc N, Perdigón G. Effects of milk fermented by Lactobacillus helveticus R389 on a murine breast cancer model. Breast Cancer Research . 2005; 7(4):R477-86. [DOI:10.1186/bcr1032] [PMID] [PMCID]
25.Choi SS, Kim Y, Han KS, You S, Oh S, Kim SH. Effects of Lactobacillus strains on cancer cell proliferation and oxidative stress in vitro. Letters in Applied Microbiology. 2006; 42(5):452-58. [DOI:10.1111/j.1472-765X.2006.01913.x] [PMID]
26.Taverniti V, Guglielmetti S. The immunomodulatory properties of probiotic microorganisms beyond their viability (ghost probiotics: Proposal of paraprobiotic concept). Genes & Nutrition. 2011; 6(3):261-74. [DOI:10.1007/s12263-011-0218-x] [PMID] [PMCID]
27.Kim Y, Oh S, Yun HS, Oh S, Kim SH. Cell-bound exopolysaccharide from probiotic bacteria induces autophagic cell death of tumour cells. Letters in Applied Microbiology. 2010; 51(2):123-30. [DOI:10.1111/j.1472-765X.2010.02859.x] [PMID]
28.Salva S, Marranzino G, Villena J, Agüero G, Alvarez S. Probiotic Lactobacillus strains protect against myelosuppression and immunosuppression in cyclophosphamide-treated mice. International Immunopharmacology. 2014; 22(1):209-21. [DOI:10.1016/j.intimp.2014.06.017] [PMID]
29.Sheng H, Shao J, Morrow JD, Beauchamp RD, Dubois RN. Modulation of apoptosis andbcl-2 exprssion by prostaglandin E2 in human colon cancer cells. Cancer Research. 1998; 58(2):362-6. [PMID]
30.Chiu YH, Hsieh YJ, Liao KW, Peng KC. Preferential promotion of apoptosis of monocytes by Lactobacillus casei rhamnosus soluble factors. Clinical Nutrition. 2010; 29(1):131-40. [DOI:10.1016/j.clnu.2009.07.004] [PMID]
31.Liu C, Pan T. In vitro effects of lactic acid bacteria on cancer cell viability and antioxidant activity. Journal of Food and Drug Analysis. 2010; 18(2):77-86. [DOI:10.38212/2224-6614.2287]
32.Iyer C, Kosters A, Sethi G, Kunnumakkara AB, Aggarwal BB, Versalovic J. Probiotic Lactobacillus reuteri promotes TNF induced apoptosis in human myeloid leukemia derived cells by modulation of NF-κB and MAPK signalling. Cellular Microbiology. 2008; 10(7):1442-52 [DOI:10.1111/j.1462-5822.2008.01137.x] [PMID]
33.Pan X, Chen F, Wu T, Tang H, Zhao Z. The acid, bile tolerance and antimicrobial property of Lactobacillus acidophilus NIT. Food Control. 2009; 20:598-602. [DOI:10.1016/j.foodcont.2008.08.019]
34.Liu Z, Qin H, Yang Z, Xia Y, Liu W, Yang J, et al. Randomised clinical trial the effects of perioperative probiotic treatment on barrier function and post operative infectious complications in colorectal cancer surgery a double blind study. Alimentary Pharmacology & Therapeutics. 2011; 33(1):50-63. [DOI:10.1111/j.1365-2036.2010.04492.x] [PMID]
35.Asgari B, Kermanian F, Khalili F, Rohani Nojede Sadat Z, Yaslianifard S. [Influence of lactobacillus brevis on the recovery of gastric gastritis caused by Helicobacter pylori infection in a C57BL / 6 mouse model (Persian)]. Knowledge Health. 2018; 13(2):15-21. [Link]
متن کامل: (2657 مشاهده)
مقدمه
یکی از شایعترین انواع سرطان دستگاه گوارش در ایران، سرطان روده بزرگ است که ازنظر بروز در مردان ایرانی رتبه سوم و در زنان رتبه چهارم را به خود اختصاص داده است [1]. در آزمایشات برونتنی نشان داده شده که پروبیوتیکها در سرکوب زخم اولیه نئوپلاستیک اولیه و تومورهای سرطانی روده بزرگ نقش دارند [2]. اثرات ضدسرطانی پروبیوتیکها ازطریق جلوگیری از تبدیل پروکارسینوژن به کارسینوژن، اتصال و غیرفعال کردن ترکیبات میتوژنی، کاهش رشد باکتریهای پروکارسینوژنز (عوامل سرطانزا)، کاهش جذب میتوژنها و افزایش عملکرد سیستم ایمنی میباشد [3]. همچنین یکی از مکانیسمهای عملکردی پروبیوتیکها ازجمله لاکتوباسیلوسها خاصیت ضدتکثیری سلولهای سرطانی، ازجمله سرطان کولون با القای آپوپتوز است [4]. سرطان کولون اغلب به شکل پولیپ در سطح جداره داخلی روده ایجاد میشود که منشأ آن پوشش داخلی روده بزرگ است. این تودهها معمولا غیرسرطانی هستند، ولی اگر درمان نشوند ممکن است به سرطان کولون تبدیل شوند [5].
عوامل مختلف مثل عوامل ژنتیکی، محیطی، و رژیم غذایی میتوانند بهعنوان عامل سرطان روده بزرگ درنظر گرفته شوند [6, 7]. نشان داده شده است که عوامل پیشنئوپلاستیک در کولون افراد مبتلا به سرطان کولون وجود دارند. شواهد نشان دادهاند که پروبیوتیکها میتوانند بهعنوان عوامل پیشگیری و تسکین علائم سرطان کولون نقش داشته باشند [8]. القـای آپوپتـوز در سـلولهـای سرطانی وابسته بـه فعـال شـدن زیرواحـدهای مسـیرهای پیامرسانی PTEN/Akt و NF- kB میباشـد. فعـال شـدن ژن PTEN) مهارکننــده تومــور) در مسیر سیگنالینگ PTEN/Akt و ژن Rel A در مسیر NF- kB ، باعث مهـار تکثیر سلولهای سـرطانی کولورکتـال، القـای آپوپتـوز، القــای توقف M/G2 چرخه سلولی میشود [9, 10]. پیامرسانی مسیر) NF- KB (فعـالشدن زیرواحدهای (IKB,RelA در تکثیر سلولی، التهـاب و آپوپتـوز ، نقش دارد [11]. از فعالشدن سیگنالینگ TLR4 منجر به فعالشدن مسیرهای MAPK، AKT و درنهایت فعال شدن NF-KB) nuclear factor، (transcription factores و APL1 (activator protein) و کنترل بیان سایتوکاینهای پیشالتهابی و دیگر ژنهای در ارتباط با ایمنی میشود، سیگنالینگ TLR4 همچنین سبب فعالشدن IRF3) interferon regulatory factor) و القای بیان ژنهای Iinterferon) (IFNB و INF-responsive میشود [12]. پروبیوتیکها میکروارگانیسمهای زنده و غیربیماریزای موجود در بعضی مواد غذایی هستند که وقتی مقادیر کافی از آنها وارد بدن شوند، تأثیر مثبتی بر سلامت میزبان میگذارند، انواع باکتریهای اسید لاکتیک شامل گونههای لاکتوباسیلوس، گونههای بیفیدوباکتریوم، گونههای انتروکوکوس فیشیوم، لاکتوکوکوس لاکتیس، لوکونوستوک مزانتروئیدس، پدیوکوکوس اسیدیلاکتی، استرپتوکوکوس ترموفیلوس از میکروارگانیسمهای پروبیوتیک میباشند. لاکتوباسیلها و بیفیدوباکتریوم از متداولترین باکتریهای مورداستفاده بهعنوان پروبیوتیک میباشد؛ اما بعضی از مخمرها و دیگر باسیل ها نیز مورداستفاده قرار میگیرند [13].
باور موجود در مورد اثرات مفید پروبیوتیکها، بر پایه این واقعیت قرار دارد که فلور میکروبـی روده نقـش محافظـتکننده در برابر بیمـاریهـای مختلـف از خـود نشـان میدهد؛ اثر اصلی پروبیوتیکها با تثبیـت فلـورمیکروبی روده مشخص میشود [14]. پارکر پروبیوتیکها را بهعنوان ارگانیسمهایی که در برقراری تعادل میکروبی روده مؤثر هستند، تعریف کرد [15]. واژه پروبیوتیک بهمعنای محصولی حاوی میکروارگانیسمهای زنده و مشخص با تعدادی کافی میباشد که بهوسیله کولونیزاسیون در بخشی از بدن ازطریق ایجاد تعادل در فلور میکروبی باعث اعمال اثرات مفید بر سلامتی میزبان میشود [16]. واگنر و همکاران در سال2009 بیان کردند که باکتریهای لاکتوباسیلوس روتری ممکن است سرطان کلورکتال را ازطریق کاهش بیان محصولات ژنی وابسته به فاکتور هستهای NF- κB (kappaB) پیشگیری کند [17]. فاکتور رونویسی NF- KB ، یکی از مهمترین مسیرهای دارای عمل سریع و اولین عامل پاسخگو به محرکهای سلولی مضر میباشد [18]. هدف ما بررسی تأثیر باکتری لاکتوباسیلوس برویس جداسازیشده بر بیان ژنهای مرتبط با رشد Rel A, IKB و Casp3 در سلولهای سرطانی کولون HT29 میباشد.
موادو روشها
این مطالعه که از نوع تجربی آزمایشگاهی میباشد، و در مرکز تحقیقات ریزفناوری دارویی دانشگاه علوم پزشکی تبریز در سال 1398 انجام شده است. سویه باکتری لاکتوباسیلوس برویس (ATCC 13648)بهعنوان باکتریهای مفید (پروبیوتیک) از مرکز کلکسیون باکتریهای سازمان پژوهشهای علمی و صنعتی ایران تهیه شد و رده سلولی HT29 از کلکسیون سلول انیستوی پاستور تعیین شد. رده سلولی آدنوکارسینوم کولون انسانی HT-29 human colon adenocarcinoma grade II در داخل فلاسک حاوی 90 سیسی محیط کشت RPMI1640 غنیشده با 10 درصد سرم جنین گاوی Fetal Bovine Serum) FBS)، 100 ماکرولیتر آنتیبیوتیک (penicillin 0.1μg/μL and streptomycin 0.1 μg/μL) در انکوباتور در شرایط دمای 37 درجه سانتیگراد و دیاکسیدکربن 5 درصد کشت داده شد. سپس سلولها پاساژ داده شد. باتوجهبه محاسبات مربوط به غلظت مناسب سلولی موردنظر برای انجام آزمایشات، مقدار مورد نیاز از سوسپانسیون سلولی توسط محیط کشت کامل به حجم موردنظر رسانده شد و بعد از بررسی فلاسک موردنظر توسط میکروسکوپ، مورد بررسی قرار گرفت سپس در انکوباتور 37 درجه انکوبه شدند [19]. کشت باکتری لاکتوباسیلوس نیز در محیط کشت مایع نوترینت انجام شد مقدار 68 گرم از پودر آماده محیط را در یک لیتر آب مقطر حل کرده و سپس محیط موردنظر را توسط دستگاه اتوکلاو در دمای 121 درجه سانتیگراد و بهمدت 20 دقیقه استریل کردیم. برای تهیه سوپرناتانت باکتریها، باکتریهای Lactobacillus brevis i در محیط کشت مایع MRS (De Man, Rogosa and Sharpe agar) کشت داده شدند و جهت کشت بهینه در انکوباتور با دمای 37 درجه سانتیگراد نگهداری شدند.
تست MTT) Microculture Tetrazolium Test)
(سنجش تکثیر و بقای سلول با استفاده از نشانگر فلورسنت)
اثر سمیت سلولی باکتری لاکتوباسیلوس برویس بر روی سلولهای سرطانی ذکر شده با روش رنگسنجی، با استفاده از رنگ تترازولیوم با نام شیمیایی 3-(4,5-dimethylthiazol-2yl)-2,5-dipheny Tetrazolium bromide که اختصاراً MTT نامیده میشود. هدف از بررسی MTT سنجش و تکثیر با استفاده از نشانگر فلورسنت میباشد که در مقایسه با گروه کنترل بررسی شد. ابتدا تعداد مناسبی از سلولهایی HT29 در هریک از چاهکها کشت داده میشوند (12000 تا 10000 سلول در هر چاهک) بعد از 24 ساعت چاهکها کنترل شده و مقدار مناسبی از باکتری ترموفیلوس زنده به چاهکها افزوده میشود به چاهکها 3 نوع OD مختلف باکتری افزوده میشود 0/5، 1 و 1/5 بارپلیتها بهمدت 4 ساعت جهت تأثیر باکتریها انکوبه میشوند. OD باکتریها در طول موج 600 نانومتر اندازهگیری شده است، میزان باکتری در OD1 برابر است با 109×8 سلول در هر میلیلیتر است. این میزان برای OD2 برابر است با 109×1/6 سلول در هر میلیلیتر، برای OD1. 5 برابر است با 109×1/2 سلول در هر میلیلیتر و برای OD. 5 میشود 108×4 سلول در هر میلیلیتر. پس از هر زمان انکوباسیون محیط داخل چاهکها دور ریخته شده و هر خانه با 200 میکرولیتر محیط تازه و 50 میکرولیتر محلول MTT (2 میلیگرم در میلیلیتر حلشده در PBS) جایگزین میشود. سلول تیمارنشده با باکتری بهعنوان کنترل بهکار برده شدند. سپس پلیتها بهمدت 4 ساعت دیگر در دمای 37 درجه سانتیگراد و در تاریکی انکوبه شدند. پس از آن، محلول MTT با 200 میکرولیتر (Dimethyl sulfoxide)DMSO بههمراه 25 میکرولیتر بافر سورنسون (گلایسین M 0/1، Nacl M 0/1 دارای H 10/5 بهینه شده با NaOH M 1) جایگزین شد. سپس پلیتها بهمدت 15 دقیقه در دمای 37 درجه سانتیگراد شیک شدند.
برای تعیین درصد زنده بودن سلولها دراین مرحله سلولها با تریپان بلو رنگآمیزی شده، به این شکل که 100 ماکرولیتر از محلول حاوی سلولها را از زیر هود برداشته و داخل تیوب 2 سیسی ریخته شد و 100 ماکرولیتر تریپان بلو افزوده و به خوبی مخلوط شد. بعد با استفاده از لام نئوبار شمارش سلولی انجام شد. میانگین بهدست آمده را ضربدر 100 و ضریب رقت کرده که تعداد سلولها در یک میلیمتر محلول بهدست آمد. جذب نوری در طول موج 570 نانومتر با دستگاه الیزا ریدر سنجیده شد. درصد بقای سلولی در گروه کنترل منفی 100 منظور و درصد بقاء سلولهایی که تحتتأثیر غلظتهای مختلف باکتری قرار گرفته بودند با تقسیم جذب چاهکهای تیمار شده به جذب کنترل منفی ضرب در 100 محاسبه شد. غلظتی از ترکیبات مورد آزمایش که درصد حیات سلولی را به نصف تقلیل دهد، بهعنوان IC 50 در نظر گرفته شد. این مقدار از روی نمودار با استفاده از نرمافزار اکسل تعیین شد [20].
رنگآمیزی سلولی دپی
هدف از رنگآمیزی دپی، تأثیر باکتری بر روی تحلیل رفتن هسته سلولهای سرطانی میباشد. برای بررسی مستقیم اثرلاکتوباسیلوس برویس بر سلولهای HT29، بعد از تیمار همه سلولها با محیط کاندیشن بهمدت 24 ساعت مایع رویینی محیط کشت سلولها را کاملاً خالی شد و با افزودن60 ماکرولیتر پارافرمالدهید 4 درصد به هر چاهک بهمدت 8 دقیقه فیکس شدند. سلولهای داخل هر چاهک را با 60 ماکرولیتر (Phosphate Buffer Solution Preparation)PBS 3 بار شستوشو داده شد و هر بار 5 دقیقه PBS را در داخل چاهکها نگه داشته شد. سپس سلولهای داخل هر چاهک با 60 ماکرولیتر محلول نفوذپذیرکننده Triton x-100 تریتون ایکس 100، 0.1% بهمدت 10 دقیقه نفوذپذیرشدند؛ سپس سلولها پاساژ داده شدند. بعد به سلولهای داخل هر چاهک 50 ماکرولیتر رنگ DAPI4’,6-diamidino-2-phenylindole) ) را ریخته و بهمدت 10 دقیقه صبر کرده، و دوباره 3 بار با PBS بهمدت 5 دقیقه شستشو داده شد و بعد داخل هر چاهک 50 ماکرولیتر PBS ریخته و پلیتها تا قبل از عکسبرداری، داخل یخچال قرارداده شدند. سلولها با میکروسکوپ فلورسانت Olympus IX81 invert مجهز بهOlympus DP70 camera Olympus Corp., Tokyo, Japan) مورد ارزیابی قرار گرفتند [21].
استخراج RNA با ترایزول
برای استخراج RNA به سلولهای تیمارشده با باکتری در هر چاهک پلیت 6 خانه، 500 ماکرولیتر ترایزول ریخته و 20 دقیقه در دمای اتاق قرار داده شدند تا سلولها کاملاً لیز شوند؛ سپس محتویات هر چاهک پلیت 6 خانه را به تیوبهای 2 سیسی منتقل شده سپس به هرکدام از تیوبها حدود 200 ماکرولیتر کلروفرم اضافه شد. سپس تیوبها بهمدت 10 دقیقه در 12000 دور سانتریقیوژ شد و به تیوبهای 2 سیسی جدید منتقل شدند. بعد به هر تیوب 2/5 برابر حجم نمونه ایزوپروپانول سرد افزوده شده و بهمدت 24 ساعت در فریزر 70- درجه قرار گرفت. سپس تیوبها را بهمدت 10 دقیقه در 12000 دور سانتریفیوژ کرده و مایع روی تیوبها بیرون ریخته شد. تیوبها خشک شده و بعد به هرکدام از تیوبها 20 ماکرولیتر DEPC ریخته سپس OD و غلظت آنها برحسب نانوگرم بر میلیلیتر با دستگاه نانو دراپ سنجیده شد. بهمنظور بررسی کیفیت RNAهای استخراجشده، 5 نمونه بهصورت تصادفی روی ژل آگاروز 2 درصد برای 1 ساعت در ولتاژ 80 ولت الکتروفورز شد [22].
سنتز CDNA
1 میکروگرم از total RNA که با 0/2 ماکرومولار هگزامر پرایمر universal رونویسی معکوس می شود و یک ماکرولیتر (10mM) dNTP و آب DEPC مخلوطشده و با حرارت 65 درجه بهمدت 5 دقیقه انکوبه شدند، بعد روی یخ قرار داده و سپس 5 یونیت آنزیم RT(MMLV) بافر 1x) buffer for MMLV RT) یک یونیت بر ماکرولیتر مهارگر RNase را افزوده شده و در انتها حجم کلی هر تیوب 20 ماکرولیتر شد. بعد تیوبها در دستگاه ترموسایکلر قرار داده شد و به دستگاه برنامه:10 دقیقه 25 درجه، 60 دقیقه 42 درجه و 10 دقیقه 72 درجه داده شد تا cDNA ها سنتز شوند.
استخراج DNA ی ژنومی باکتری لاکتوباسیلوس برویس
محیط کشت حاوی باکتریها را به تیوبهای 2 سیسی منتقل و با 10000 دور بر دقیقه بهمدت 5 دقیقه سانتریفیوژ شد. مایع رویی تیوبها را بیرون ریخته، سپس 800 ماکرولیتر لیزبافر حاوی هیدروکسیدسدیم و SDS میباشد، به هرکدام از تیوبها افزوده شد؛ سپس تیوبها بهمدت30 دقیقه در بنماری 85 درجه سانتیگراد قرار داده شد. در مرحله بعد، تیوبها را بهمدت 10 دقیقه در فریزر70- درجه قرار داده و دوباره بهمدت 5 تا 6 دقیقه در بنماری 85 درجه سانتیگراد قرار داده شد. بعد 700 ماکرولیتر محلول کلروفرم-ایزوآمیل الکل، حاوی 24 سیسی کلروفرم و 1 سیسی ایزوآمیل الکل به هرکدام از تیوبها اضافه شد و در مرحله بعد تیوبها با 12000 دور بر دقیقه بهمدت 5 دقیقه سانتریفیوژ شدند. سپس مایع رویی تیوبها که حاوی DNA است به تیوبهای 2 سیسی جدید منتقل شده، بعد یک و نیم برابر حجم نمونهها ایزوپروپانل سرد به تیوبهای جدید افزوده شد و بهمدت یک شبانه روز در فریزر70- قرار داده شدند. سپس نمونهها با دور rpm 12000 بهمدت 5 دقیقه سانتریفیوژ شدند. مایع رویی را بیرون ریخته و پس از خشک شدن 50 ماکرولیتر آب مقطر دیونیزه DNase free به هرکدام از تیوبها افزوده شد.
طراحی پرایمر
پرایمرهای مورداستفاده توسط نرمافزار Oligo5 طراحی و توسط وبسایت بلاست و مرکز ملی اطلاعات زیستفناوری شدند. پرایمرها توسط شرکت تکاپوزیست سنتز شدند (جدول شماره 1).

Real-time RT-PCR
واکنش Real time PCR (BIO-RAD iQ5, USA) بهصورت تکرارهای 3 تایی و طبق برنامه دمایی که اطلاعات آن در جدول شماره 2 موجود است صورت گرفت.

بدین شکل که در تیوبهای مخصوص Real time PCR 1 ماکرولیتر cDNA و 19 ماکرولیتر مسترمیکس سایبرگرین حاوی 1 ماکرولیتر پرایمر فوروارد (0/2 ماکرو مولار)، 1 ماکرولیتر پرایمر ریورز (0/2 ماکرو مولار)، 7 ماکرولیتر DEPC و 10 ماکرولیتر Mastermix 1x Real time ریخته شد. بعد تیوبها را در دستگاه Real time PCR قرار داده و دستگاه run شد و از ژن GAPDH بهعنوان زن کنترل داخلی درنظر گرفته شد
تحلیل آماری دادهها
در مورد نتایج بهدست آمده برای میزان بیان ژنها، ابتدا CTهای بهدست آمده برای هر ژن توسط فرمول 2-DDCT محاسبه شد. سپس، میانگین (سه بار تکرار) نتایج بهدست آمده توسط نرمافزار آماری SPSS در هر گروه محاسبه شد؛ سپس توزیع نرمال بودن نتایج توسط آزمون شاپیرو ویلک بررسی شد. برای تجزیه دادهها از آزمون آماری تحلیل واریانس یکطرفه استفاده شد. برای مقایسه میانگین گروهها از آزمون حداقل اختلاف معنادار استفاده شد. آزمونها زمانی معنادار درنظر گرفته شدند که مقدارP کمتر از 0/05 بود. سپس نسبت بیان هر ژن نسبت به ژن رفرنس محاسبه شد.
یافتهها
کشندگی لاکتوباسیل بر روی رده سلولی HT29
بهمنظور بررسی اثر کشندگی باکتریهای لاکتوباسیلوس برویس بر روی سلولهای HT29، ابتدا تعداد سلولهای موردنیاز جهت آزمایش بهینهسازی شدند. سلولهای مذکور به تعداد 10000 عدد در هر چاهک پلیت 96 خانه کشت داده شدند. سپس این سلولها در انکوباتور 37 درجه انکوبه شدند. سلولها یک روز بعد که مقدارشان 20 هزار عدد شد؛ یعنی زمانی که 2 برابر شدند، با غلظتهای افزایشی باکتریها همجوار شده و پس از 4 ساعت همجواری محیط رویی بهنام کاندیشن مدیا فیلتر شده و به سلولهای جدید در ساعتهای مختلف اضافه شدند. برای هر غلظت باکتری 3 تکرار درنظر گرفته شد و 3 خانه بهعنوان کنترل با محیط کاندیشن تیمار نشدند. بعد از 12 و 24 و 48 ساعت تیمار سلولها با محیط فیلتر شده کاندیشن لاکتوباسیلوس برویس نتایج بهدست آمد. نتایج حاصل از MTT در تصویر شماره 1 و 2 نشان داده شدهاند.
یکی از شایعترین انواع سرطان دستگاه گوارش در ایران، سرطان روده بزرگ است که ازنظر بروز در مردان ایرانی رتبه سوم و در زنان رتبه چهارم را به خود اختصاص داده است [1]. در آزمایشات برونتنی نشان داده شده که پروبیوتیکها در سرکوب زخم اولیه نئوپلاستیک اولیه و تومورهای سرطانی روده بزرگ نقش دارند [2]. اثرات ضدسرطانی پروبیوتیکها ازطریق جلوگیری از تبدیل پروکارسینوژن به کارسینوژن، اتصال و غیرفعال کردن ترکیبات میتوژنی، کاهش رشد باکتریهای پروکارسینوژنز (عوامل سرطانزا)، کاهش جذب میتوژنها و افزایش عملکرد سیستم ایمنی میباشد [3]. همچنین یکی از مکانیسمهای عملکردی پروبیوتیکها ازجمله لاکتوباسیلوسها خاصیت ضدتکثیری سلولهای سرطانی، ازجمله سرطان کولون با القای آپوپتوز است [4]. سرطان کولون اغلب به شکل پولیپ در سطح جداره داخلی روده ایجاد میشود که منشأ آن پوشش داخلی روده بزرگ است. این تودهها معمولا غیرسرطانی هستند، ولی اگر درمان نشوند ممکن است به سرطان کولون تبدیل شوند [5].
عوامل مختلف مثل عوامل ژنتیکی، محیطی، و رژیم غذایی میتوانند بهعنوان عامل سرطان روده بزرگ درنظر گرفته شوند [6, 7]. نشان داده شده است که عوامل پیشنئوپلاستیک در کولون افراد مبتلا به سرطان کولون وجود دارند. شواهد نشان دادهاند که پروبیوتیکها میتوانند بهعنوان عوامل پیشگیری و تسکین علائم سرطان کولون نقش داشته باشند [8]. القـای آپوپتـوز در سـلولهـای سرطانی وابسته بـه فعـال شـدن زیرواحـدهای مسـیرهای پیامرسانی PTEN/Akt و NF- kB میباشـد. فعـال شـدن ژن PTEN) مهارکننــده تومــور) در مسیر سیگنالینگ PTEN/Akt و ژن Rel A در مسیر NF- kB ، باعث مهـار تکثیر سلولهای سـرطانی کولورکتـال، القـای آپوپتـوز، القــای توقف M/G2 چرخه سلولی میشود [9, 10]. پیامرسانی مسیر) NF- KB (فعـالشدن زیرواحدهای (IKB,RelA در تکثیر سلولی، التهـاب و آپوپتـوز ، نقش دارد [11]. از فعالشدن سیگنالینگ TLR4 منجر به فعالشدن مسیرهای MAPK، AKT و درنهایت فعال شدن NF-KB) nuclear factor، (transcription factores و APL1 (activator protein) و کنترل بیان سایتوکاینهای پیشالتهابی و دیگر ژنهای در ارتباط با ایمنی میشود، سیگنالینگ TLR4 همچنین سبب فعالشدن IRF3) interferon regulatory factor) و القای بیان ژنهای Iinterferon) (IFNB و INF-responsive میشود [12]. پروبیوتیکها میکروارگانیسمهای زنده و غیربیماریزای موجود در بعضی مواد غذایی هستند که وقتی مقادیر کافی از آنها وارد بدن شوند، تأثیر مثبتی بر سلامت میزبان میگذارند، انواع باکتریهای اسید لاکتیک شامل گونههای لاکتوباسیلوس، گونههای بیفیدوباکتریوم، گونههای انتروکوکوس فیشیوم، لاکتوکوکوس لاکتیس، لوکونوستوک مزانتروئیدس، پدیوکوکوس اسیدیلاکتی، استرپتوکوکوس ترموفیلوس از میکروارگانیسمهای پروبیوتیک میباشند. لاکتوباسیلها و بیفیدوباکتریوم از متداولترین باکتریهای مورداستفاده بهعنوان پروبیوتیک میباشد؛ اما بعضی از مخمرها و دیگر باسیل ها نیز مورداستفاده قرار میگیرند [13].
باور موجود در مورد اثرات مفید پروبیوتیکها، بر پایه این واقعیت قرار دارد که فلور میکروبـی روده نقـش محافظـتکننده در برابر بیمـاریهـای مختلـف از خـود نشـان میدهد؛ اثر اصلی پروبیوتیکها با تثبیـت فلـورمیکروبی روده مشخص میشود [14]. پارکر پروبیوتیکها را بهعنوان ارگانیسمهایی که در برقراری تعادل میکروبی روده مؤثر هستند، تعریف کرد [15]. واژه پروبیوتیک بهمعنای محصولی حاوی میکروارگانیسمهای زنده و مشخص با تعدادی کافی میباشد که بهوسیله کولونیزاسیون در بخشی از بدن ازطریق ایجاد تعادل در فلور میکروبی باعث اعمال اثرات مفید بر سلامتی میزبان میشود [16]. واگنر و همکاران در سال2009 بیان کردند که باکتریهای لاکتوباسیلوس روتری ممکن است سرطان کلورکتال را ازطریق کاهش بیان محصولات ژنی وابسته به فاکتور هستهای NF- κB (kappaB) پیشگیری کند [17]. فاکتور رونویسی NF- KB ، یکی از مهمترین مسیرهای دارای عمل سریع و اولین عامل پاسخگو به محرکهای سلولی مضر میباشد [18]. هدف ما بررسی تأثیر باکتری لاکتوباسیلوس برویس جداسازیشده بر بیان ژنهای مرتبط با رشد Rel A, IKB و Casp3 در سلولهای سرطانی کولون HT29 میباشد.
موادو روشها
این مطالعه که از نوع تجربی آزمایشگاهی میباشد، و در مرکز تحقیقات ریزفناوری دارویی دانشگاه علوم پزشکی تبریز در سال 1398 انجام شده است. سویه باکتری لاکتوباسیلوس برویس (ATCC 13648)بهعنوان باکتریهای مفید (پروبیوتیک) از مرکز کلکسیون باکتریهای سازمان پژوهشهای علمی و صنعتی ایران تهیه شد و رده سلولی HT29 از کلکسیون سلول انیستوی پاستور تعیین شد. رده سلولی آدنوکارسینوم کولون انسانی HT-29 human colon adenocarcinoma grade II در داخل فلاسک حاوی 90 سیسی محیط کشت RPMI1640 غنیشده با 10 درصد سرم جنین گاوی Fetal Bovine Serum) FBS)، 100 ماکرولیتر آنتیبیوتیک (penicillin 0.1μg/μL and streptomycin 0.1 μg/μL) در انکوباتور در شرایط دمای 37 درجه سانتیگراد و دیاکسیدکربن 5 درصد کشت داده شد. سپس سلولها پاساژ داده شد. باتوجهبه محاسبات مربوط به غلظت مناسب سلولی موردنظر برای انجام آزمایشات، مقدار مورد نیاز از سوسپانسیون سلولی توسط محیط کشت کامل به حجم موردنظر رسانده شد و بعد از بررسی فلاسک موردنظر توسط میکروسکوپ، مورد بررسی قرار گرفت سپس در انکوباتور 37 درجه انکوبه شدند [19]. کشت باکتری لاکتوباسیلوس نیز در محیط کشت مایع نوترینت انجام شد مقدار 68 گرم از پودر آماده محیط را در یک لیتر آب مقطر حل کرده و سپس محیط موردنظر را توسط دستگاه اتوکلاو در دمای 121 درجه سانتیگراد و بهمدت 20 دقیقه استریل کردیم. برای تهیه سوپرناتانت باکتریها، باکتریهای Lactobacillus brevis i در محیط کشت مایع MRS (De Man, Rogosa and Sharpe agar) کشت داده شدند و جهت کشت بهینه در انکوباتور با دمای 37 درجه سانتیگراد نگهداری شدند.
تست MTT) Microculture Tetrazolium Test)
(سنجش تکثیر و بقای سلول با استفاده از نشانگر فلورسنت)
اثر سمیت سلولی باکتری لاکتوباسیلوس برویس بر روی سلولهای سرطانی ذکر شده با روش رنگسنجی، با استفاده از رنگ تترازولیوم با نام شیمیایی 3-(4,5-dimethylthiazol-2yl)-2,5-dipheny Tetrazolium bromide که اختصاراً MTT نامیده میشود. هدف از بررسی MTT سنجش و تکثیر با استفاده از نشانگر فلورسنت میباشد که در مقایسه با گروه کنترل بررسی شد. ابتدا تعداد مناسبی از سلولهایی HT29 در هریک از چاهکها کشت داده میشوند (12000 تا 10000 سلول در هر چاهک) بعد از 24 ساعت چاهکها کنترل شده و مقدار مناسبی از باکتری ترموفیلوس زنده به چاهکها افزوده میشود به چاهکها 3 نوع OD مختلف باکتری افزوده میشود 0/5، 1 و 1/5 بارپلیتها بهمدت 4 ساعت جهت تأثیر باکتریها انکوبه میشوند. OD باکتریها در طول موج 600 نانومتر اندازهگیری شده است، میزان باکتری در OD1 برابر است با 109×8 سلول در هر میلیلیتر است. این میزان برای OD2 برابر است با 109×1/6 سلول در هر میلیلیتر، برای OD1. 5 برابر است با 109×1/2 سلول در هر میلیلیتر و برای OD. 5 میشود 108×4 سلول در هر میلیلیتر. پس از هر زمان انکوباسیون محیط داخل چاهکها دور ریخته شده و هر خانه با 200 میکرولیتر محیط تازه و 50 میکرولیتر محلول MTT (2 میلیگرم در میلیلیتر حلشده در PBS) جایگزین میشود. سلول تیمارنشده با باکتری بهعنوان کنترل بهکار برده شدند. سپس پلیتها بهمدت 4 ساعت دیگر در دمای 37 درجه سانتیگراد و در تاریکی انکوبه شدند. پس از آن، محلول MTT با 200 میکرولیتر (Dimethyl sulfoxide)DMSO بههمراه 25 میکرولیتر بافر سورنسون (گلایسین M 0/1، Nacl M 0/1 دارای H 10/5 بهینه شده با NaOH M 1) جایگزین شد. سپس پلیتها بهمدت 15 دقیقه در دمای 37 درجه سانتیگراد شیک شدند.
برای تعیین درصد زنده بودن سلولها دراین مرحله سلولها با تریپان بلو رنگآمیزی شده، به این شکل که 100 ماکرولیتر از محلول حاوی سلولها را از زیر هود برداشته و داخل تیوب 2 سیسی ریخته شد و 100 ماکرولیتر تریپان بلو افزوده و به خوبی مخلوط شد. بعد با استفاده از لام نئوبار شمارش سلولی انجام شد. میانگین بهدست آمده را ضربدر 100 و ضریب رقت کرده که تعداد سلولها در یک میلیمتر محلول بهدست آمد. جذب نوری در طول موج 570 نانومتر با دستگاه الیزا ریدر سنجیده شد. درصد بقای سلولی در گروه کنترل منفی 100 منظور و درصد بقاء سلولهایی که تحتتأثیر غلظتهای مختلف باکتری قرار گرفته بودند با تقسیم جذب چاهکهای تیمار شده به جذب کنترل منفی ضرب در 100 محاسبه شد. غلظتی از ترکیبات مورد آزمایش که درصد حیات سلولی را به نصف تقلیل دهد، بهعنوان IC 50 در نظر گرفته شد. این مقدار از روی نمودار با استفاده از نرمافزار اکسل تعیین شد [20].
رنگآمیزی سلولی دپی
هدف از رنگآمیزی دپی، تأثیر باکتری بر روی تحلیل رفتن هسته سلولهای سرطانی میباشد. برای بررسی مستقیم اثرلاکتوباسیلوس برویس بر سلولهای HT29، بعد از تیمار همه سلولها با محیط کاندیشن بهمدت 24 ساعت مایع رویینی محیط کشت سلولها را کاملاً خالی شد و با افزودن60 ماکرولیتر پارافرمالدهید 4 درصد به هر چاهک بهمدت 8 دقیقه فیکس شدند. سلولهای داخل هر چاهک را با 60 ماکرولیتر (Phosphate Buffer Solution Preparation)PBS 3 بار شستوشو داده شد و هر بار 5 دقیقه PBS را در داخل چاهکها نگه داشته شد. سپس سلولهای داخل هر چاهک با 60 ماکرولیتر محلول نفوذپذیرکننده Triton x-100 تریتون ایکس 100، 0.1% بهمدت 10 دقیقه نفوذپذیرشدند؛ سپس سلولها پاساژ داده شدند. بعد به سلولهای داخل هر چاهک 50 ماکرولیتر رنگ DAPI4’,6-diamidino-2-phenylindole) ) را ریخته و بهمدت 10 دقیقه صبر کرده، و دوباره 3 بار با PBS بهمدت 5 دقیقه شستشو داده شد و بعد داخل هر چاهک 50 ماکرولیتر PBS ریخته و پلیتها تا قبل از عکسبرداری، داخل یخچال قرارداده شدند. سلولها با میکروسکوپ فلورسانت Olympus IX81 invert مجهز بهOlympus DP70 camera Olympus Corp., Tokyo, Japan) مورد ارزیابی قرار گرفتند [21].
استخراج RNA با ترایزول
برای استخراج RNA به سلولهای تیمارشده با باکتری در هر چاهک پلیت 6 خانه، 500 ماکرولیتر ترایزول ریخته و 20 دقیقه در دمای اتاق قرار داده شدند تا سلولها کاملاً لیز شوند؛ سپس محتویات هر چاهک پلیت 6 خانه را به تیوبهای 2 سیسی منتقل شده سپس به هرکدام از تیوبها حدود 200 ماکرولیتر کلروفرم اضافه شد. سپس تیوبها بهمدت 10 دقیقه در 12000 دور سانتریقیوژ شد و به تیوبهای 2 سیسی جدید منتقل شدند. بعد به هر تیوب 2/5 برابر حجم نمونه ایزوپروپانول سرد افزوده شده و بهمدت 24 ساعت در فریزر 70- درجه قرار گرفت. سپس تیوبها را بهمدت 10 دقیقه در 12000 دور سانتریفیوژ کرده و مایع روی تیوبها بیرون ریخته شد. تیوبها خشک شده و بعد به هرکدام از تیوبها 20 ماکرولیتر DEPC ریخته سپس OD و غلظت آنها برحسب نانوگرم بر میلیلیتر با دستگاه نانو دراپ سنجیده شد. بهمنظور بررسی کیفیت RNAهای استخراجشده، 5 نمونه بهصورت تصادفی روی ژل آگاروز 2 درصد برای 1 ساعت در ولتاژ 80 ولت الکتروفورز شد [22].
سنتز CDNA
1 میکروگرم از total RNA که با 0/2 ماکرومولار هگزامر پرایمر universal رونویسی معکوس می شود و یک ماکرولیتر (10mM) dNTP و آب DEPC مخلوطشده و با حرارت 65 درجه بهمدت 5 دقیقه انکوبه شدند، بعد روی یخ قرار داده و سپس 5 یونیت آنزیم RT(MMLV) بافر 1x) buffer for MMLV RT) یک یونیت بر ماکرولیتر مهارگر RNase را افزوده شده و در انتها حجم کلی هر تیوب 20 ماکرولیتر شد. بعد تیوبها در دستگاه ترموسایکلر قرار داده شد و به دستگاه برنامه:10 دقیقه 25 درجه، 60 دقیقه 42 درجه و 10 دقیقه 72 درجه داده شد تا cDNA ها سنتز شوند.
استخراج DNA ی ژنومی باکتری لاکتوباسیلوس برویس
محیط کشت حاوی باکتریها را به تیوبهای 2 سیسی منتقل و با 10000 دور بر دقیقه بهمدت 5 دقیقه سانتریفیوژ شد. مایع رویی تیوبها را بیرون ریخته، سپس 800 ماکرولیتر لیزبافر حاوی هیدروکسیدسدیم و SDS میباشد، به هرکدام از تیوبها افزوده شد؛ سپس تیوبها بهمدت30 دقیقه در بنماری 85 درجه سانتیگراد قرار داده شد. در مرحله بعد، تیوبها را بهمدت 10 دقیقه در فریزر70- درجه قرار داده و دوباره بهمدت 5 تا 6 دقیقه در بنماری 85 درجه سانتیگراد قرار داده شد. بعد 700 ماکرولیتر محلول کلروفرم-ایزوآمیل الکل، حاوی 24 سیسی کلروفرم و 1 سیسی ایزوآمیل الکل به هرکدام از تیوبها اضافه شد و در مرحله بعد تیوبها با 12000 دور بر دقیقه بهمدت 5 دقیقه سانتریفیوژ شدند. سپس مایع رویی تیوبها که حاوی DNA است به تیوبهای 2 سیسی جدید منتقل شده، بعد یک و نیم برابر حجم نمونهها ایزوپروپانل سرد به تیوبهای جدید افزوده شد و بهمدت یک شبانه روز در فریزر70- قرار داده شدند. سپس نمونهها با دور rpm 12000 بهمدت 5 دقیقه سانتریفیوژ شدند. مایع رویی را بیرون ریخته و پس از خشک شدن 50 ماکرولیتر آب مقطر دیونیزه DNase free به هرکدام از تیوبها افزوده شد.
طراحی پرایمر
پرایمرهای مورداستفاده توسط نرمافزار Oligo5 طراحی و توسط وبسایت بلاست و مرکز ملی اطلاعات زیستفناوری شدند. پرایمرها توسط شرکت تکاپوزیست سنتز شدند (جدول شماره 1).

Real-time RT-PCR
واکنش Real time PCR (BIO-RAD iQ5, USA) بهصورت تکرارهای 3 تایی و طبق برنامه دمایی که اطلاعات آن در جدول شماره 2 موجود است صورت گرفت.

بدین شکل که در تیوبهای مخصوص Real time PCR 1 ماکرولیتر cDNA و 19 ماکرولیتر مسترمیکس سایبرگرین حاوی 1 ماکرولیتر پرایمر فوروارد (0/2 ماکرو مولار)، 1 ماکرولیتر پرایمر ریورز (0/2 ماکرو مولار)، 7 ماکرولیتر DEPC و 10 ماکرولیتر Mastermix 1x Real time ریخته شد. بعد تیوبها را در دستگاه Real time PCR قرار داده و دستگاه run شد و از ژن GAPDH بهعنوان زن کنترل داخلی درنظر گرفته شد
تحلیل آماری دادهها
در مورد نتایج بهدست آمده برای میزان بیان ژنها، ابتدا CTهای بهدست آمده برای هر ژن توسط فرمول 2-DDCT محاسبه شد. سپس، میانگین (سه بار تکرار) نتایج بهدست آمده توسط نرمافزار آماری SPSS در هر گروه محاسبه شد؛ سپس توزیع نرمال بودن نتایج توسط آزمون شاپیرو ویلک بررسی شد. برای تجزیه دادهها از آزمون آماری تحلیل واریانس یکطرفه استفاده شد. برای مقایسه میانگین گروهها از آزمون حداقل اختلاف معنادار استفاده شد. آزمونها زمانی معنادار درنظر گرفته شدند که مقدارP کمتر از 0/05 بود. سپس نسبت بیان هر ژن نسبت به ژن رفرنس محاسبه شد.
یافتهها
کشندگی لاکتوباسیل بر روی رده سلولی HT29
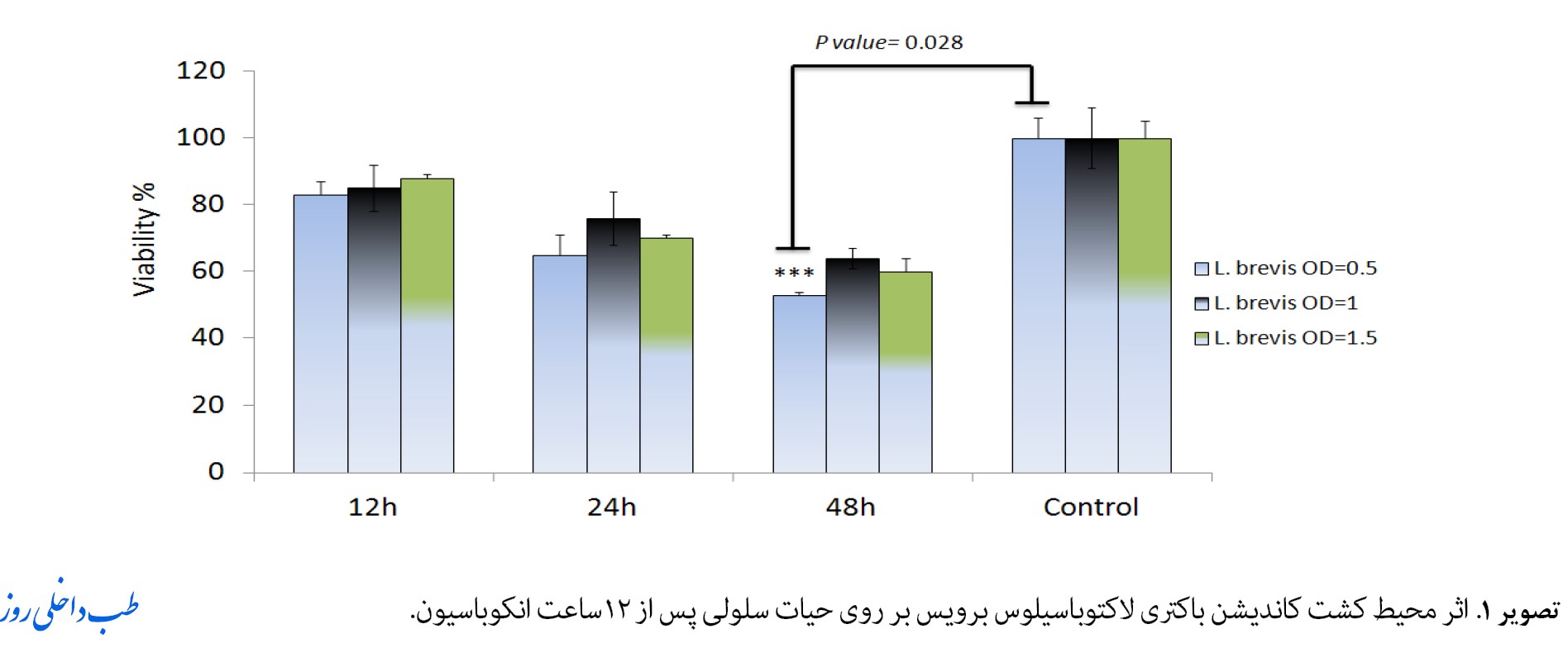
بهمنظور بررسی اثر کشندگی باکتریهای لاکتوباسیلوس برویس بر روی سلولهای HT29، ابتدا تعداد سلولهای موردنیاز جهت آزمایش بهینهسازی شدند. سلولهای مذکور به تعداد 10000 عدد در هر چاهک پلیت 96 خانه کشت داده شدند. سپس این سلولها در انکوباتور 37 درجه انکوبه شدند. سلولها یک روز بعد که مقدارشان 20 هزار عدد شد؛ یعنی زمانی که 2 برابر شدند، با غلظتهای افزایشی باکتریها همجوار شده و پس از 4 ساعت همجواری محیط رویی بهنام کاندیشن مدیا فیلتر شده و به سلولهای جدید در ساعتهای مختلف اضافه شدند. برای هر غلظت باکتری 3 تکرار درنظر گرفته شد و 3 خانه بهعنوان کنترل با محیط کاندیشن تیمار نشدند. بعد از 12 و 24 و 48 ساعت تیمار سلولها با محیط فیلتر شده کاندیشن لاکتوباسیلوس برویس نتایج بهدست آمد. نتایج حاصل از MTT در تصویر شماره 1 و 2 نشان داده شدهاند.
سلولهای HT29 تحتتأثیر غلظتهای مختلف باکتری لاکتوباسیلوس برویس قرار گرفتند. شایان ذکر است طی مدت 48 ساعت انکوبه شدن سلولهای HT29 با باکتریهای لاکتوباسیلوس برویس میزان IC50 مشخصی با غلظت od=0.5 حاصل شد.
همچنین طبق روش ذکرشده در بخش روش بررسی پس از تیمار سلولها بهمنظور بررسی آپوپتوز، بر روی سلولها رنگآمیزی DAPI انجام شد. تصویر شماره 1 سلولهای رنگشده و رنگنشده توسط میکروسکوپ نوری و فلورسنت تصویربرداری شده را نشان میدهد.
همانطور که نشان داده شده است سلولهای موردتیمار در مقایسه با سلولهای بدون تیمار با محیط کاندیشن باکتری وارد آپوپتوز شده و هستههای ریزتری را تشکیل دادهاند. A: سلولهای سالم با میکروسکوپ نوری معمولی (سلولهای HT29 بهصورت نرمال رشد میکنند). C: سلولهای رنگشده با DAPI زیر میکروسکوپ فلورسنت و سالم بدون تیمار با محیط کاندیشن (هسته سلولهای HT29 را نشان میدهد که با رنگآمیزی دپی بهصورت آبی و بدون هیچ تغییری بهصورت کروی دیده میشوند). B: سلولهای سالم بدون زیر میکروسکوپ نوری معمولی (سلولهای HT29 تحتتأثیر باکتری لاکتوباسلوس برویس به سمت آپوپتوز یا از بین رفتن میروند). D: هسته سلولهای آپوپتوز شده و رنگشده با DAPI زیر میکروسکوپ فلورسنت که هستههای قطعهقطعه شده دارند (هسته سلولهای HT29 را نشان میدهد که بهصورت متورم و تکهتکه شده میباشند.
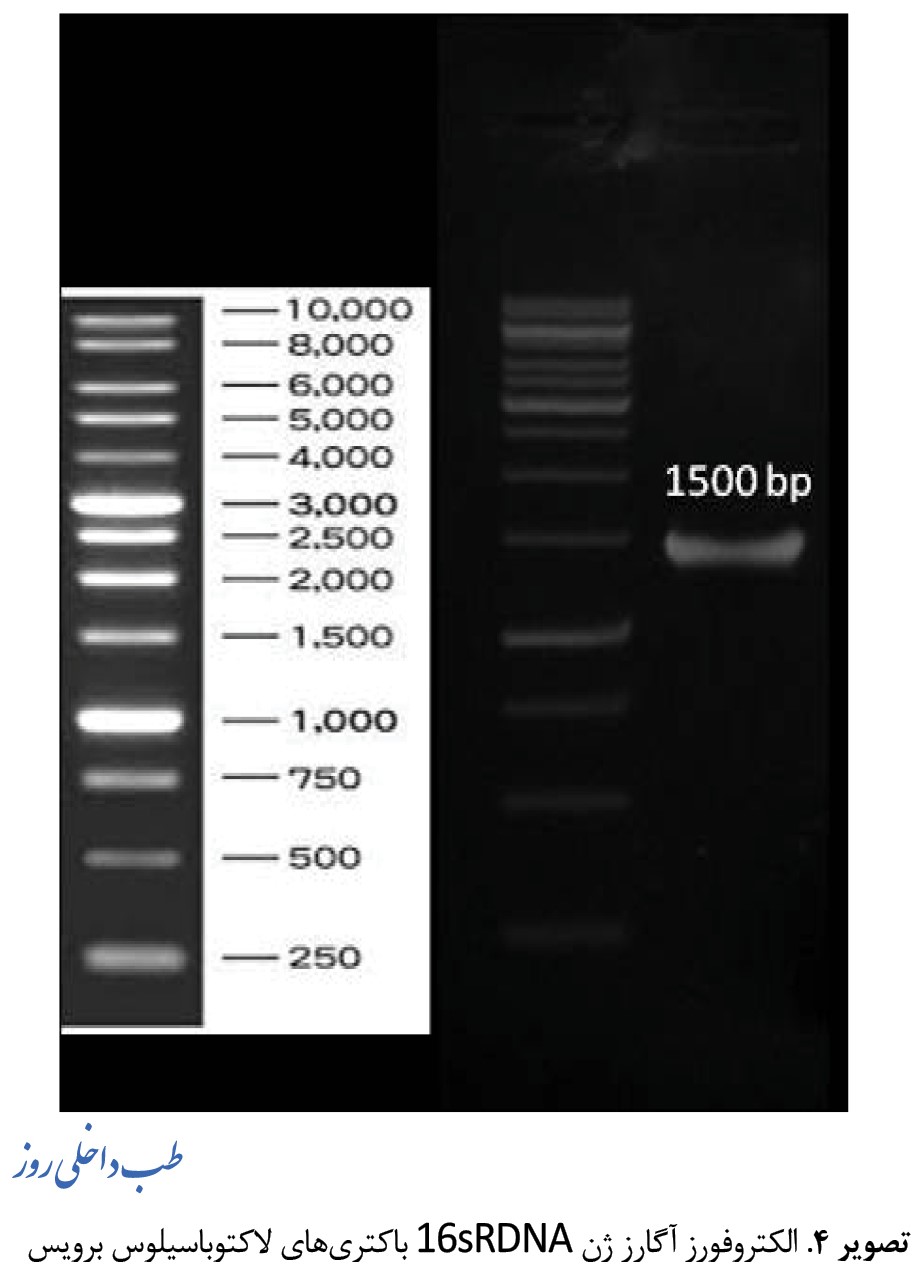
انجام واکنش زنجیرهای PCR برای ژن 16S rdna باکتریهای لاکتوباسیلوس برویسژن 16S rdnaبرای تأیید و تعیین هویت مولکولی باکتری لالکتوباسیلوس برویس به روش PCR مورد استفاده د. پس از انجام PCR قطعه تکثیری برای ژن 16S rdna ، 1500 جفت باز آورد شده است. پس از انجام پی سی آر، محصول PCR در آگارز 2 درصد الکتروفورز شد و نتیجه الکتروفورز در تصاویر شماره 3، 4 و 5 آورده شده است.
همچنین طبق روش ذکرشده در بخش روش بررسی پس از تیمار سلولها بهمنظور بررسی آپوپتوز، بر روی سلولها رنگآمیزی DAPI انجام شد. تصویر شماره 1 سلولهای رنگشده و رنگنشده توسط میکروسکوپ نوری و فلورسنت تصویربرداری شده را نشان میدهد.
همانطور که نشان داده شده است سلولهای موردتیمار در مقایسه با سلولهای بدون تیمار با محیط کاندیشن باکتری وارد آپوپتوز شده و هستههای ریزتری را تشکیل دادهاند. A: سلولهای سالم با میکروسکوپ نوری معمولی (سلولهای HT29 بهصورت نرمال رشد میکنند). C: سلولهای رنگشده با DAPI زیر میکروسکوپ فلورسنت و سالم بدون تیمار با محیط کاندیشن (هسته سلولهای HT29 را نشان میدهد که با رنگآمیزی دپی بهصورت آبی و بدون هیچ تغییری بهصورت کروی دیده میشوند). B: سلولهای سالم بدون زیر میکروسکوپ نوری معمولی (سلولهای HT29 تحتتأثیر باکتری لاکتوباسلوس برویس به سمت آپوپتوز یا از بین رفتن میروند). D: هسته سلولهای آپوپتوز شده و رنگشده با DAPI زیر میکروسکوپ فلورسنت که هستههای قطعهقطعه شده دارند (هسته سلولهای HT29 را نشان میدهد که بهصورت متورم و تکهتکه شده میباشند.
انجام واکنش زنجیرهای PCR برای ژن 16S rdna باکتریهای لاکتوباسیلوس برویسژن 16S rdnaبرای تأیید و تعیین هویت مولکولی باکتری لالکتوباسیلوس برویس به روش PCR مورد استفاده د. پس از انجام PCR قطعه تکثیری برای ژن 16S rdna ، 1500 جفت باز آورد شده است. پس از انجام پی سی آر، محصول PCR در آگارز 2 درصد الکتروفورز شد و نتیجه الکتروفورز در تصاویر شماره 3، 4 و 5 آورده شده است.
همانطورکه مشاهده میشود باند شارپ نشاندهنده تکثیر اختصاصی میباشد.
نتایج Real-time PCR
برای انجام این آزمایش، سلولها در پلیتهای 6 خانهای با غلظتهای IC50 محیط کشت داده شده (کاندیشن) باکتری های لاکتوباسیلوس برویس تیمار شدند و آزمایش صورت پذیرفت که نتایج و نمودارهایش به شرح ذیل می باشد.
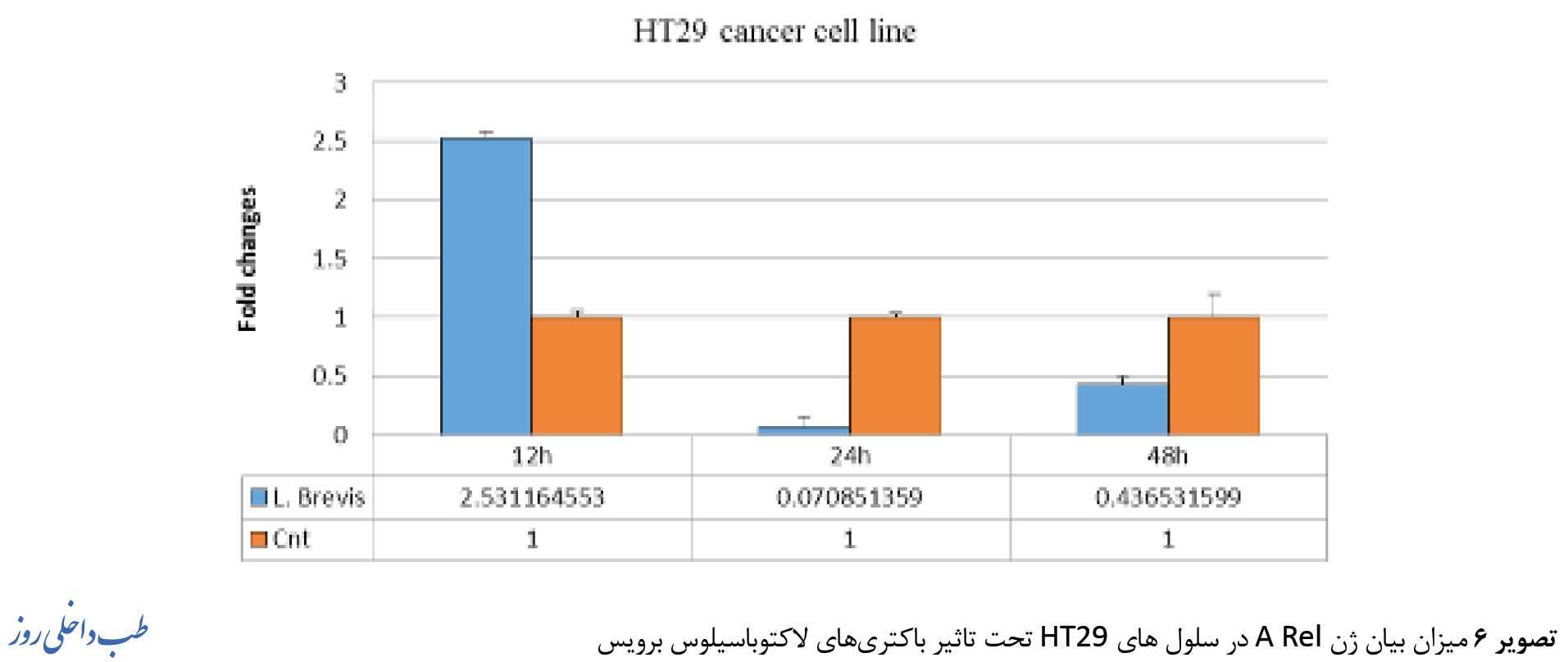
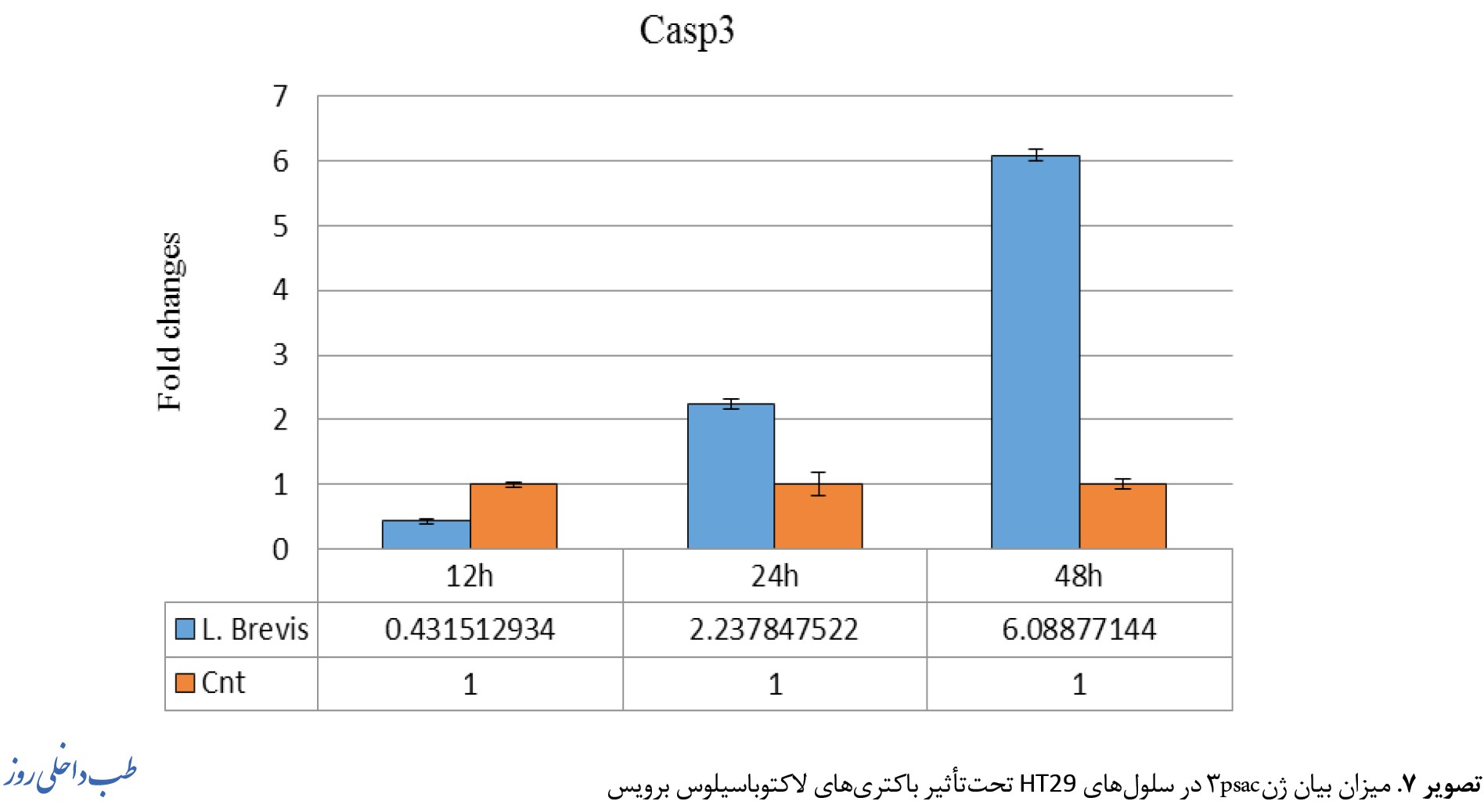
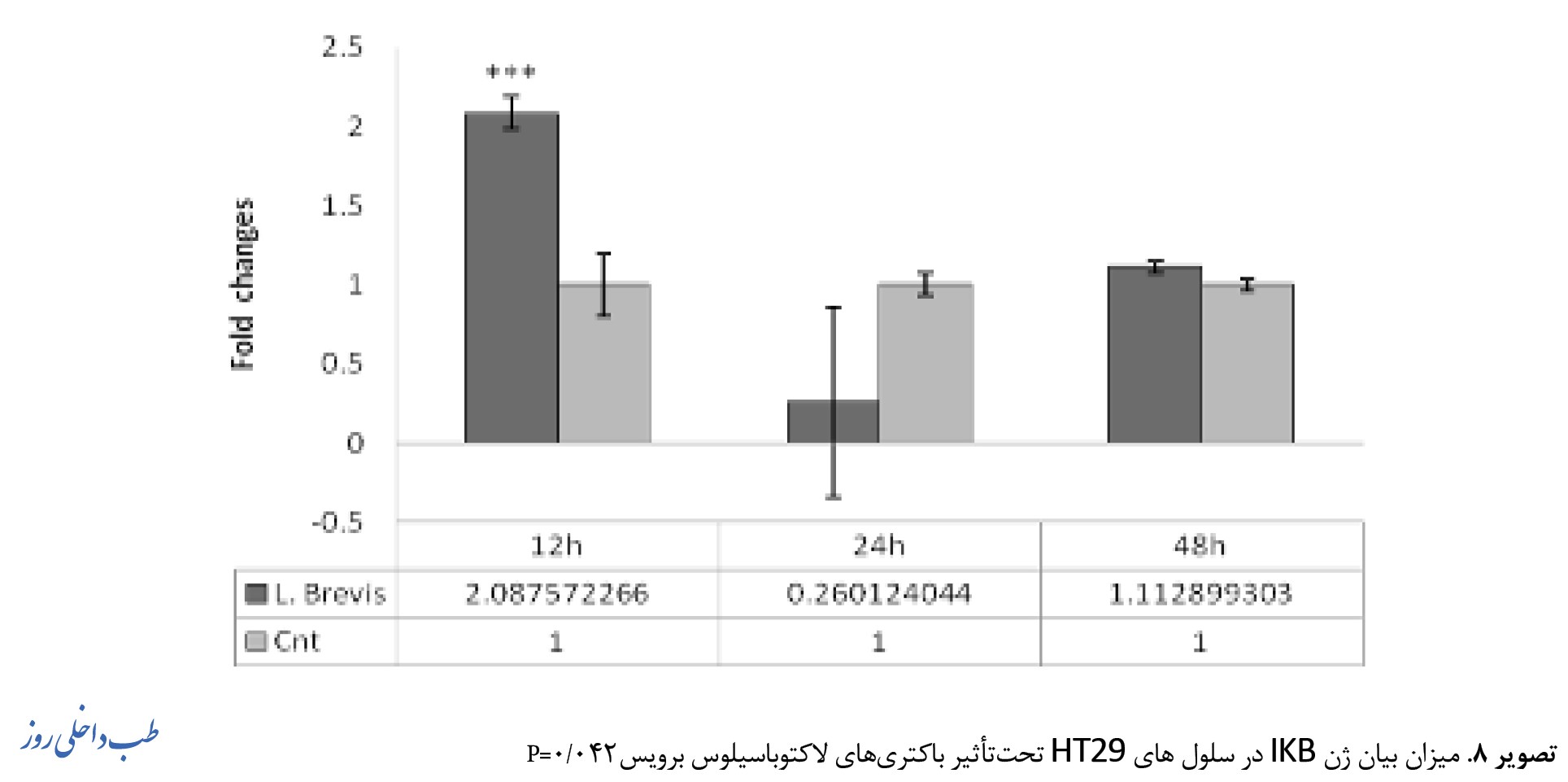
میزان بیان ژنهای Rel A ، IKB و Casp3 در کشت همجوار سلولهای سرطانی کولون HT29 با باکتری لاکتوباسیلوس برویس در تصاویر 6، 7، 8 نشان داده شده است.
بهصورت تکی بهمدت 12 و 24 و 48 ساعت تیمار شدند و میزان تغییرات بیان ژن HT29 به روش Real time PCR مورد سنجش قرار گرفت. تمامی آزمایشات 3 بار تکرار شد و P 0/05 معنادار (***) درنظر گرفته شد. بیان ژن Rel A در رده سلولی HT29 پس از مجاورتهای دوزاژی مختلف و در بازه زمانی 12 الی 48 ساعت مورد ارزیابی قرار گرفت. نتایج حاصل نشان داد بیان ژن Rel A در 48 ساعت اول رابطه معناداری دارد (تصویر شماره 6).
نتایج Real-time PCR
برای انجام این آزمایش، سلولها در پلیتهای 6 خانهای با غلظتهای IC50 محیط کشت داده شده (کاندیشن) باکتری های لاکتوباسیلوس برویس تیمار شدند و آزمایش صورت پذیرفت که نتایج و نمودارهایش به شرح ذیل می باشد.
میزان بیان ژنهای Rel A ، IKB و Casp3 در کشت همجوار سلولهای سرطانی کولون HT29 با باکتری لاکتوباسیلوس برویس در تصاویر 6، 7، 8 نشان داده شده است.
بهصورت تکی بهمدت 12 و 24 و 48 ساعت تیمار شدند و میزان تغییرات بیان ژن HT29 به روش Real time PCR مورد سنجش قرار گرفت. تمامی آزمایشات 3 بار تکرار شد و P 0/05 معنادار (***) درنظر گرفته شد. بیان ژن Rel A در رده سلولی HT29 پس از مجاورتهای دوزاژی مختلف و در بازه زمانی 12 الی 48 ساعت مورد ارزیابی قرار گرفت. نتایج حاصل نشان داد بیان ژن Rel A در 48 ساعت اول رابطه معناداری دارد (تصویر شماره 6).
بهصورت تکی بهمدت 12 و 24 و 48 ساعت تیمار شدند و میزان تغییرات بیان ژن HT29 به روش Real time PCR مورد سنجش قرار گرفت. تمامی آزمایشات 3 بار تکرار شد و P 0/05 معنادار (***) درنظر گرفته شد. 0/038=P بیان ژن IKB در رده سلولی HT29 پس از مجاورتهای دوزاژی مختلف و در بازه زمانی 12، 24و 48 ساعت مورد ارزیابی قرار گرفت. نتایج حاصل نشان داد بیان ژن IKB در 48 ساعت اول رابطه معناداری پیدا میکند 0/042=Pبهصورت تکی بهمدت و 12 و 24 و 48 ساعت تیمار شدند و میزان تغییرات بیان ژن HT29 به روش Real time PCR مورد سنجش قرار گرفت. تمامی آزمایشات 3 بار تکرار شد و 0/05>P معنادار درنظر گرفته شد (تصویر شماره 7).
بیان ژن casp3 در رده سلولی HT29 پس از مجاورتهای دوزاژی مختلف و در بازه زمانی 12 الی 24 ساعت مورد ارزیابی قرار گرفت. نتایج حاصل نشان داد بیان ژن casp3 در 48 ساعت اول رابطه معناداری پیدا میکند (0/038=P). بهصورت تکی بهمدت 12 و 24 و 48 ساعت تیمار شدند و میزان تغییرات بیان ژن HT29 به روش Real time PCR موردسنجش قرار گرفت. تمامی آزمایشات 3 بار تکرار شد و 0/05>P معنادار درنظر گرفته شد (0/038=P) (تصویر شماره 8).
بحث
در میان تمامی پروبیوتیـکهـا، بـاکتریهـای خـانواده لاکتوباسیلوس نظیـر لاکتوباسـیلوس اسـیدوفیلوس، لاکتوباسیلوس کـازئی و لاکتوباسـیلوس دلبـورکی ازجملـه مهـمتـرین اجـزا فلـور نرمـال روده انسـان و حیوانات میباشند. علاوهبر این نقش پروبیوتیکهای لاکتوباسیلی بر تسهیل درمان سرطان کولورکتال بـهخوبی شناخته شده است که با مطالعه ما همخوانی دارد [23، 24]. در تحقیق حاضر، اثر لاکتوباسیلوس برویس در جلوگیری از متاستاز سلولهای سرطانی کولون ارزیابی شد. نتایج حاصل از آزمایش MTT نشان داد که باکتریهای لاکتوباسیلوس برویس تکثیر سلولهای HT29 را مهار کرده و سبب القای آپوپتوز در این سلولها میشوند و تکثیر ژن Rel A را از طریق افزایش بیان ژن IKB دراین سلولها مهار میکنند. نتایج دپی و DNA ladder assay حاصل از تیمار سلولهای HT29 با باکتریهای ذکر شده، تغییرات کیفی آپوپتوز سلولی را نشان داد. علاوهبر این نتایج Real-time PCR نشان داد که باکتریهای لاکتوباسیلوس برویس سبب افزایش بیان ژن casp3 در سلولهای سرطانی کولون HT29 شد. برطبق مطالعات چیو و همکارانش در سال 2006 بر روی تعداد زیادی لاکتوباسیلها ازجمله، لاکتوباسیلوس اسیدوفیلوس لاکتوباسیلوس برویس و لاکتوباسیلوس کازئی که توسط حرارت کشته شده بودند نشان داد که سبب کاهش درصد زیستایی ردههای سلولهای سرطانی شد.
در مطالعه حاضر هم لاکتو باسیلوس برویس سبب کاهش درصد زیستایی رده سلولی HT-29 شد؛ بنابراین مطالعه چوی و همکارانش با مطالعه ما همخوانی دارد. [25]. برطبق مطالعات انجامشده توسط تاورنیتی و همکاران در سال 2011 لاکتوباسیل پلانتاروم و لاکتوباسیلوس کازئی لاکتوباسیلوس بولگاریکوس سبب کاهش درصد زیستایی سلولهای HT-29 و Caco-2 شدند که در مطالعه حاضر لاکتوباسیلوس برویس هم سبب کاهش درصد زیستایی سلولهای HT-29 شد؛ بنابراین مطالعه تاورنیتی و همکاران با مطالعه ما همخوانی دارد [26]. کیم و همکارانش در سال 2010، پیشنهاد دادند که ترکیبات بهدست آمده از باکتریهای پروبیوتیک توانایی مهار تعدادی از سرطانها را دارند. آنها براساس تجزیه پروتئوم دریافتند که چندین پروتئین در مرگ سلولی به طریق اتوفاژ دخالت دارند که شامل: GRP78 و Beclin-1 میباشند که توسط پلی ساکاریدهای خارج سلولی تنظیم میشوند [27]. سلوا و همکاران در سال 2014 در مطالعهای نشان دادند که لاکتوباسیلهای پروبیوتیک نیز در برابر سرکوب میلو-فسفامید ناشی از سیکلوفسفامید در مدلهای حیوانی محافظت میکنند که منجر به بهبود مقاومت به کاندیدا آلبیکنس شده است. در نتیجه، پروبیوتیکها بهعنوان روشی برای کاهش سرکوب سیستم ایمنی در بیماران سرطانی پیشنهاد شدهاند [28]. همچنین مطالعه دیگری که مطالعه حاضر را تأیید میکند توسط شنگ و همکاران در سال 1998انجام شده است. آنها لاکتوباسیل پلانتاروم را به عنوان باکتری پروبیوتیک بر روی سلولهای سرطانی HT29 استفاده و مسیر PTEN را بهعنوان مسیر آپوپتوز سلولهای سرطانی معرفی کردند [29]. چیو و همکاران در سال 2010 نیز با تحقیقات خود نشان دادند که ترکیبات محلول ترشح شده از لاکتوباسیلوس کازئی و رامنوسوس باعث القای آپوپتوزیس در سلولهای لوکمیای مونوسیتی میشوند، درنتیجه میتوان پروبیوتیکها را بهعنوان عاملی ایمن برای مبارزه با سرطان درنظر گرفت که هیچگونه عارضه جانبی در پی ندارند که با مطالعه ما همخوانی دارد [30]. لیو و پان نیز در سال 2010 ده سویه بومی لاکتوباسیلوس در تایوان و دو باکتری اسید لاکتیک را مورد استفاده قرار دادند. آنها از اجزاء سیتوپلاسم و باکتری کشته شده توسط حرارت بر روی ردههای سلول سرطانی کولون و سینه جهت آزمایشات خود استفاده کردند. نتایج آنها نشان داد، اثر ممانعتی بسته به نوع سوش متفاوت میباشد، ولی سلول کشته شده توسط حرارت لاکتوباسیلوسها کاهش در صد زیستایی را نشان داد که دراین مطالعه هم لاکتوباسیلوس برویس باعث کاهش درصد زیستایی رده سلولی HT-29 میشود؛ بنابراین با مطالعه ما همخوانی دارد [31].
لایر و همکاران در سال 2008 دریافتند که لاکتوباسیلوس روتری فعالیت NF-κB القاشده توسط TNF را در یک دوز و وضعیت وابسته به زمان مهار میکند [32]. پان و همکاران در سال 2009 اثرات تجویز دهانی باکتریهای لاکتوباسیلوس اسیدوفیلوس را روی سرطانهای کولورکتال موشها تجزیهوتحلیل کردند. نتــایج دلالـت بر آن داشـــت که لاکتوباسیلوس اسیدوفیلوس شدت کارسینوژنز (عوامل سرطانزا) کلورکتال را کاهش دادند. از طرفی مرگ برنامهریزیشده سلولی را در موهای تیمار شده افزایش دادند. در مطالعه حاضر هم لاکتو باسیلوس برویس هم عوامل سرطانزا کلورکتال را کاهش داد که با مطالعه ما همخوانی دارد [33]. لیو و همکاران در سال 2011 در مطالعهای آزمونهای بالینی تأثیر پروبیوتیکها در کاهش عوارض عفونی پس از جراحی را در بیماران سرطان کلورکتال نشان دادهاند. بهطور مشابهی، پیامدهای عملی و کیفیت در ارتباط با سلامتی طول عمر بهطور چشمگیری در بیمارانی که تحت جراحی برشی ســرطان کلورکتال در پی تـیمار با لاکتوباسیلوس اسیدوفیلوس و باسیلوس سوبتیلیس قرار گرفته بودند، بهبود یافت [34].
ارکید و همکاران در سال 2018 با بررسی تأثیر لاکتوباسیلوس برویس بر بهبود گاستریت معده ناشی از عفونت هلیکوباکتر پیلوری مدل موشی نشان دادند که در گروههای آلوده به عفونت بعد از درمان با لاکتوباسیلوس برویس کاهش التهاب و بهبودی حاصل شد. میزان ریشهکنی عفونت هلیکوباکتر پیلوری در گروه درمانی، بعد از بررسی بافتی، کاهش تهاب را نشان داد. در مطالعه حاضر هم لاکتوباسلوس برویس باعث کاهش عوامل سرطانزای کولورکتال و رده سلولی HT-29 میشود؛ بنابراین نتایج مطالعه Orcid، با مطالعه ما همخوانی دارد [35].
نتیجهگیری
یافتههای ما نشان میدهد که لاکتوباسیلوس برویس مسیر سیگنالینگ سلولی آپوپتوز در سلولهای سرطانی کولون HT29 را تحریک کرده و میتوان درجهت استراتژی جدید درمانی و یا اجوانت تراپی برای تیمار سرطان کولون استفاده کرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشگاه آزاد اسلامی واحد اهر با کد 22030507971002 تأیید شده است.
حامی مالی
این مقاله برگرفته از پایاننامه کارشناسی ارشد آقای حچت عادلی در گروه میکروبیولوژی، دانشگاه آزاد اسلامی واحد اهر است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از تمامی کسانی که در این پژوهش ما را یاری کردند، تقدیر و تشکر میشود.
در میان تمامی پروبیوتیـکهـا، بـاکتریهـای خـانواده لاکتوباسیلوس نظیـر لاکتوباسـیلوس اسـیدوفیلوس، لاکتوباسیلوس کـازئی و لاکتوباسـیلوس دلبـورکی ازجملـه مهـمتـرین اجـزا فلـور نرمـال روده انسـان و حیوانات میباشند. علاوهبر این نقش پروبیوتیکهای لاکتوباسیلی بر تسهیل درمان سرطان کولورکتال بـهخوبی شناخته شده است که با مطالعه ما همخوانی دارد [23، 24]. در تحقیق حاضر، اثر لاکتوباسیلوس برویس در جلوگیری از متاستاز سلولهای سرطانی کولون ارزیابی شد. نتایج حاصل از آزمایش MTT نشان داد که باکتریهای لاکتوباسیلوس برویس تکثیر سلولهای HT29 را مهار کرده و سبب القای آپوپتوز در این سلولها میشوند و تکثیر ژن Rel A را از طریق افزایش بیان ژن IKB دراین سلولها مهار میکنند. نتایج دپی و DNA ladder assay حاصل از تیمار سلولهای HT29 با باکتریهای ذکر شده، تغییرات کیفی آپوپتوز سلولی را نشان داد. علاوهبر این نتایج Real-time PCR نشان داد که باکتریهای لاکتوباسیلوس برویس سبب افزایش بیان ژن casp3 در سلولهای سرطانی کولون HT29 شد. برطبق مطالعات چیو و همکارانش در سال 2006 بر روی تعداد زیادی لاکتوباسیلها ازجمله، لاکتوباسیلوس اسیدوفیلوس لاکتوباسیلوس برویس و لاکتوباسیلوس کازئی که توسط حرارت کشته شده بودند نشان داد که سبب کاهش درصد زیستایی ردههای سلولهای سرطانی شد.
در مطالعه حاضر هم لاکتو باسیلوس برویس سبب کاهش درصد زیستایی رده سلولی HT-29 شد؛ بنابراین مطالعه چوی و همکارانش با مطالعه ما همخوانی دارد. [25]. برطبق مطالعات انجامشده توسط تاورنیتی و همکاران در سال 2011 لاکتوباسیل پلانتاروم و لاکتوباسیلوس کازئی لاکتوباسیلوس بولگاریکوس سبب کاهش درصد زیستایی سلولهای HT-29 و Caco-2 شدند که در مطالعه حاضر لاکتوباسیلوس برویس هم سبب کاهش درصد زیستایی سلولهای HT-29 شد؛ بنابراین مطالعه تاورنیتی و همکاران با مطالعه ما همخوانی دارد [26]. کیم و همکارانش در سال 2010، پیشنهاد دادند که ترکیبات بهدست آمده از باکتریهای پروبیوتیک توانایی مهار تعدادی از سرطانها را دارند. آنها براساس تجزیه پروتئوم دریافتند که چندین پروتئین در مرگ سلولی به طریق اتوفاژ دخالت دارند که شامل: GRP78 و Beclin-1 میباشند که توسط پلی ساکاریدهای خارج سلولی تنظیم میشوند [27]. سلوا و همکاران در سال 2014 در مطالعهای نشان دادند که لاکتوباسیلهای پروبیوتیک نیز در برابر سرکوب میلو-فسفامید ناشی از سیکلوفسفامید در مدلهای حیوانی محافظت میکنند که منجر به بهبود مقاومت به کاندیدا آلبیکنس شده است. در نتیجه، پروبیوتیکها بهعنوان روشی برای کاهش سرکوب سیستم ایمنی در بیماران سرطانی پیشنهاد شدهاند [28]. همچنین مطالعه دیگری که مطالعه حاضر را تأیید میکند توسط شنگ و همکاران در سال 1998انجام شده است. آنها لاکتوباسیل پلانتاروم را به عنوان باکتری پروبیوتیک بر روی سلولهای سرطانی HT29 استفاده و مسیر PTEN را بهعنوان مسیر آپوپتوز سلولهای سرطانی معرفی کردند [29]. چیو و همکاران در سال 2010 نیز با تحقیقات خود نشان دادند که ترکیبات محلول ترشح شده از لاکتوباسیلوس کازئی و رامنوسوس باعث القای آپوپتوزیس در سلولهای لوکمیای مونوسیتی میشوند، درنتیجه میتوان پروبیوتیکها را بهعنوان عاملی ایمن برای مبارزه با سرطان درنظر گرفت که هیچگونه عارضه جانبی در پی ندارند که با مطالعه ما همخوانی دارد [30]. لیو و پان نیز در سال 2010 ده سویه بومی لاکتوباسیلوس در تایوان و دو باکتری اسید لاکتیک را مورد استفاده قرار دادند. آنها از اجزاء سیتوپلاسم و باکتری کشته شده توسط حرارت بر روی ردههای سلول سرطانی کولون و سینه جهت آزمایشات خود استفاده کردند. نتایج آنها نشان داد، اثر ممانعتی بسته به نوع سوش متفاوت میباشد، ولی سلول کشته شده توسط حرارت لاکتوباسیلوسها کاهش در صد زیستایی را نشان داد که دراین مطالعه هم لاکتوباسیلوس برویس باعث کاهش درصد زیستایی رده سلولی HT-29 میشود؛ بنابراین با مطالعه ما همخوانی دارد [31].
لایر و همکاران در سال 2008 دریافتند که لاکتوباسیلوس روتری فعالیت NF-κB القاشده توسط TNF را در یک دوز و وضعیت وابسته به زمان مهار میکند [32]. پان و همکاران در سال 2009 اثرات تجویز دهانی باکتریهای لاکتوباسیلوس اسیدوفیلوس را روی سرطانهای کولورکتال موشها تجزیهوتحلیل کردند. نتــایج دلالـت بر آن داشـــت که لاکتوباسیلوس اسیدوفیلوس شدت کارسینوژنز (عوامل سرطانزا) کلورکتال را کاهش دادند. از طرفی مرگ برنامهریزیشده سلولی را در موهای تیمار شده افزایش دادند. در مطالعه حاضر هم لاکتو باسیلوس برویس هم عوامل سرطانزا کلورکتال را کاهش داد که با مطالعه ما همخوانی دارد [33]. لیو و همکاران در سال 2011 در مطالعهای آزمونهای بالینی تأثیر پروبیوتیکها در کاهش عوارض عفونی پس از جراحی را در بیماران سرطان کلورکتال نشان دادهاند. بهطور مشابهی، پیامدهای عملی و کیفیت در ارتباط با سلامتی طول عمر بهطور چشمگیری در بیمارانی که تحت جراحی برشی ســرطان کلورکتال در پی تـیمار با لاکتوباسیلوس اسیدوفیلوس و باسیلوس سوبتیلیس قرار گرفته بودند، بهبود یافت [34].
ارکید و همکاران در سال 2018 با بررسی تأثیر لاکتوباسیلوس برویس بر بهبود گاستریت معده ناشی از عفونت هلیکوباکتر پیلوری مدل موشی نشان دادند که در گروههای آلوده به عفونت بعد از درمان با لاکتوباسیلوس برویس کاهش التهاب و بهبودی حاصل شد. میزان ریشهکنی عفونت هلیکوباکتر پیلوری در گروه درمانی، بعد از بررسی بافتی، کاهش تهاب را نشان داد. در مطالعه حاضر هم لاکتوباسلوس برویس باعث کاهش عوامل سرطانزای کولورکتال و رده سلولی HT-29 میشود؛ بنابراین نتایج مطالعه Orcid، با مطالعه ما همخوانی دارد [35].
نتیجهگیری
یافتههای ما نشان میدهد که لاکتوباسیلوس برویس مسیر سیگنالینگ سلولی آپوپتوز در سلولهای سرطانی کولون HT29 را تحریک کرده و میتوان درجهت استراتژی جدید درمانی و یا اجوانت تراپی برای تیمار سرطان کولون استفاده کرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشگاه آزاد اسلامی واحد اهر با کد 22030507971002 تأیید شده است.
حامی مالی
این مقاله برگرفته از پایاننامه کارشناسی ارشد آقای حچت عادلی در گروه میکروبیولوژی، دانشگاه آزاد اسلامی واحد اهر است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از تمامی کسانی که در این پژوهش ما را یاری کردند، تقدیر و تشکر میشود.
References
1.Kich DM, Vincenzi A, Majolo F, Volkende Souza CF, Goettert MI. Probiotic: Effectiveness nutrition in cancer treatment and prevention. Nutricion Hospitalaria. 2016; 33(6):1430-7. [DOI:10.20960/nh.806] [PMID]
2.Guandalini S, Cernat E, Moscoso D. Prebiotics and probiotics inirritable bowel syndromeand inflammatory bowel disease in children. Beneficial Microbes. 2015; 6(2):209-17. [DOI:10.3920/BM2014.0067] [PMID]
3.Whelan K. Probiotics and prebiotics in the management of irritable bowel syndrome: A review of recent clinical trials and systematic reviews. Current Opinion in Clinical Nutrition and Metabolic Care. 2011; 14(6):581-7 [DOI:10.1097/MCO.0b013e32834b8082] [PMID]
4.Barrons R, Tassone D. Use of Lactobacillus probiotics for bacterial genitourinary infections in women: A review. Clinical Therapeutics. 2008; 30(3):453-68. [DOI:10.1016/j.clinthera.2008.03.013] [PMID]
5.Gertler R, Rosenberg R, Schuster T, Friess H. Defining a high-risk subgroup with colon cancer stages I and II for possible adjuvant therapy. European Journal of Cancer. 2009; 45(17):2992-9. [DOI:10.1016/j.ejca.2009.07.008] [PMID]
6.Slattery ML, Curtin K, Anderson K, Ma KN, Edwards S, Leppert M, et al. Associations between dietary intake and Ki-ras mutations in colon tumors: A population-based study. Cancer Research. 2000; 60(24):6935-41. [PMID]
7.Brink M, Weijenberg MP, de Goeij AF, SchoutenLJ, Koedijk FD, Roemen GM, et al. Fat and K-ras mutations in sporadic colorectal cancer in The Netherlands Cohort Study. Carcinogenesis. 2004; 25(9):1619-28. [DOI:10.1093/carcin/bgh177] [PMID]
8.Pretlow TP, Barrow BJ, Ashton WS, O’Riordan MA, Pretlow TG, Jurcisek JA, et al. Aberrant crypts: Putative preneoplastic foci in human colonic mucosa. Cancer Research. 1991; 51(5):1564-7. [PMID]
9.Vasudevan KM, Gurumurthy S, Rangnekar VM. Suppression of PTEN expression by NF-kappa B prevents apoptosis. Molecular and Cellular Biology. 2004; 24(3):1007-21. [DOI:10.1128/MCB.24.3.1007-1021.2004] [PMID] [PMCID]
10.Buchholz TA, Garg AK, Chakravarti N, Aggarwal BB, Esteva FJ, Kuerer HM, et al. The nuclear transcription factor kappaB/bcl-2 pathway corRel Ates with pathologic complete response to doxorubicin-based neoadjuvant chemotherapy in human breast cancer. Clinical Cancer Research. 2005; 11(23):8398-402. [DOI:10.1158/1078-0432.CCR-05-0885] [PMID]
11.Rajan T, Benluvankar V, Vincent S. Saccharomyces cerevisiae-induced apoptosis of monolayer cervical cancer cells. Asian Journal of Pharmaceutical and Clinical Research. 2017; 10(8):63-66. [DOI:10.22159/ajpcr.2017.v10i8.18818]
12.Sargent DJ, Goldberg RM, Jacobson SD, Macdonald JS, Labianca R, Haller DG, et al. A pooled analysis of adjuvant chemotherapy for resected colon cancer in elderly patients. The New England Journal of Medicine. 2001; 345(15):1091-7. [DOI:10.1056/NEJMoa010957] [PMID]
13.Sevda ER, Kopara AT, Kivance M. Cytotoxic effects of various lactic acid bacteria on Caco-2 cells. Turkish Journal of Biology. 2015; 39(1):23-30. [DOI:10.3906/biy-1402-62]
14.Salminen S, Bouley C, Bourtron-Ruault MC, Cummings JH, Franck A, Gibson GR, et al. Functional food science and gastrointestinal physiology and function. The British Journal of Nutrition. 1998; 80(S1):S147-71. [DOI:10.1079/BJN19980108] [PMID]
15.Parker RB. Probiotics, the other half of the antibiotic story. Animal Nutrition & Health.1974; 29:4-8. [Link]
16.Scherezenmeir J, de Verse M. Probiotics and synbiotics approaching a definition. The American Journal of Clinical Nutrition. 2001; 73(2): 361S-64. [DOI:10.1093/ajcn/73.2.361s]
17.Wagner EF, Nebreda AR. Signal integration by JNK and p38 MAPK pathways in cancer development. Nature Reviews. Cancer. 2009; 9(8):537-49. [DOI:10.1038/nrc2694] [PMID]
18.Mumtaz PT, Bhat SA, Ahmad SM, Dar MA, Ahmed R, Urwat U, et al. LncRNAs and immunity: Watchdogs for host pathogen interactions. Biological Procedures Online. 2017; 19:3. [DOI:10.1186/s12575-017-0052-7] [PMID] [PMCID]
19.Oliver MH, Harrison NK, Bishop JE, Cole PJ, Laurent GJ. A rapid and convenient assay for counting cells cultured in microwell plates: Application for assessment of growth factors. Journal of Cell Science. 1989; 92(Pt 3):513-8. [DOI:10.1242/jcs.92.3.513] [PMID]
20.Javidnia K, Miri R, Amirghofran Z, Jafari A, Amoozegar Z . [Cytotoxic ityandanti microbial assessment of Euphoria hebecarpa (Persian)]. Iranian Journal of Pharmaceutical Research. 2004; 3(2):75-82. [Link]
21.Enoki T, Yoshida Y, Lally J, Hatta H, Bonen A.Testosterone increases lactate transport, monocarboxylate transporter (MCT) 1 and MCT4 in ratskeletal muscle. The Journal of Physiology. 2006; 577(Pt 1):433-43. [DOI:10.1113/jphysiol.2006.115436] [PMID] [PMCID]
22.Peterson SM, Freeman JL. RNA isolation from embryonic zebrafish and cDNA synthesis for gene expression analysis. Journal of Visualized Experiments. 2009; (30):1470. [DOI:10.3791/1470]
23.Daniluk U. Probiotics, the new approach for cancer prevention and/or potentialization of anti-cancer treatment. Journal of Clinical & Experimental Oncology. 2012; 1:2. [DOI:10.4172/2324-9110.1000e105]
24.de Moreno de LeBlanc A, Matar C, LeBlanc N, Perdigón G. Effects of milk fermented by Lactobacillus helveticus R389 on a murine breast cancer model. Breast Cancer Research . 2005; 7(4):R477-86. [DOI:10.1186/bcr1032] [PMID] [PMCID]
25.Choi SS, Kim Y, Han KS, You S, Oh S, Kim SH. Effects of Lactobacillus strains on cancer cell proliferation and oxidative stress in vitro. Letters in Applied Microbiology. 2006; 42(5):452-58. [DOI:10.1111/j.1472-765X.2006.01913.x] [PMID]
26.Taverniti V, Guglielmetti S. The immunomodulatory properties of probiotic microorganisms beyond their viability (ghost probiotics: Proposal of paraprobiotic concept). Genes & Nutrition. 2011; 6(3):261-74. [DOI:10.1007/s12263-011-0218-x] [PMID] [PMCID]
27.Kim Y, Oh S, Yun HS, Oh S, Kim SH. Cell-bound exopolysaccharide from probiotic bacteria induces autophagic cell death of tumour cells. Letters in Applied Microbiology. 2010; 51(2):123-30. [DOI:10.1111/j.1472-765X.2010.02859.x] [PMID]
28.Salva S, Marranzino G, Villena J, Agüero G, Alvarez S. Probiotic Lactobacillus strains protect against myelosuppression and immunosuppression in cyclophosphamide-treated mice. International Immunopharmacology. 2014; 22(1):209-21. [DOI:10.1016/j.intimp.2014.06.017] [PMID]
29.Sheng H, Shao J, Morrow JD, Beauchamp RD, Dubois RN. Modulation of apoptosis andbcl-2 exprssion by prostaglandin E2 in human colon cancer cells. Cancer Research. 1998; 58(2):362-6. [PMID]
30.Chiu YH, Hsieh YJ, Liao KW, Peng KC. Preferential promotion of apoptosis of monocytes by Lactobacillus casei rhamnosus soluble factors. Clinical Nutrition. 2010; 29(1):131-40. [DOI:10.1016/j.clnu.2009.07.004] [PMID]
31.Liu C, Pan T. In vitro effects of lactic acid bacteria on cancer cell viability and antioxidant activity. Journal of Food and Drug Analysis. 2010; 18(2):77-86. [DOI:10.38212/2224-6614.2287]
32.Iyer C, Kosters A, Sethi G, Kunnumakkara AB, Aggarwal BB, Versalovic J. Probiotic Lactobacillus reuteri promotes TNF induced apoptosis in human myeloid leukemia derived cells by modulation of NF-κB and MAPK signalling. Cellular Microbiology. 2008; 10(7):1442-52 [DOI:10.1111/j.1462-5822.2008.01137.x] [PMID]
33.Pan X, Chen F, Wu T, Tang H, Zhao Z. The acid, bile tolerance and antimicrobial property of Lactobacillus acidophilus NIT. Food Control. 2009; 20:598-602. [DOI:10.1016/j.foodcont.2008.08.019]
34.Liu Z, Qin H, Yang Z, Xia Y, Liu W, Yang J, et al. Randomised clinical trial the effects of perioperative probiotic treatment on barrier function and post operative infectious complications in colorectal cancer surgery a double blind study. Alimentary Pharmacology & Therapeutics. 2011; 33(1):50-63. [DOI:10.1111/j.1365-2036.2010.04492.x] [PMID]
35.Asgari B, Kermanian F, Khalili F, Rohani Nojede Sadat Z, Yaslianifard S. [Influence of lactobacillus brevis on the recovery of gastric gastritis caused by Helicobacter pylori infection in a C57BL / 6 mouse model (Persian)]. Knowledge Health. 2018; 13(2):15-21. [Link]
نوع مطالعه: پژوهشی |
موضوع مقاله:
علوم پايه پزشكي
دریافت: 1400/12/16 | پذیرش: 1401/4/1 | انتشار: 1401/4/10
دریافت: 1400/12/16 | پذیرش: 1401/4/1 | انتشار: 1401/4/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






.jpg)