دوره 26، شماره 4 - ( پائیز 1399 )
جلد 26 شماره 4 صفحات 347-332 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Zohrabi Karani L, Farzanegi P, Azarbayjani M A. The Effect of 8-Weeks of Low-Intensity Swimming Training on Promyelocytic Leukemia Zinc Finger Protein and Spermatid Transition Nuclear Protein Gene Expression in Azoospermic Rats Model. Intern Med Today 2020; 26 (4) :332-347
URL: http://imtj.gmu.ac.ir/article-1-3423-fa.html
URL: http://imtj.gmu.ac.ir/article-1-3423-fa.html
ظهرابی کرانی لیلا، فرزانگی پروین، آذربایجانی محمدعلی. تأثیر 8 هفته تمرین شنا با شدت پایین بر بیان ژن PLZF و TNP در موش های صحرایی مدل آزواسپرمی. طب داخلی روز. 1399; 26 (4) :332-347
1- دانشجوی دکتری فیزیولوژی ورزشی، گروه فیزیولوزی ورزشی، دانشگاه آزاد اسلامی، واحد ساری، ساری، ایران.
2- دانشیار، گروه فیزیولوزی ورزشی، دانشگاه آزاد اسلامی، واحد ساری، ساری، ایران. ،parvin.farzanegi@gmail.com
3- استاد فیزولوژی ورزشی، گروه فیزیولوزی ورزشی، واحد تهران مرکزی، دانشگاه آزاد اسلامی، تهران، ایران.
2- دانشیار، گروه فیزیولوزی ورزشی، دانشگاه آزاد اسلامی، واحد ساری، ساری، ایران. ،
3- استاد فیزولوژی ورزشی، گروه فیزیولوزی ورزشی، واحد تهران مرکزی، دانشگاه آزاد اسلامی، تهران، ایران.
متن کامل [PDF 4177 kb]
(1750 دریافت)
| چکیده (HTML) (3365 مشاهده)
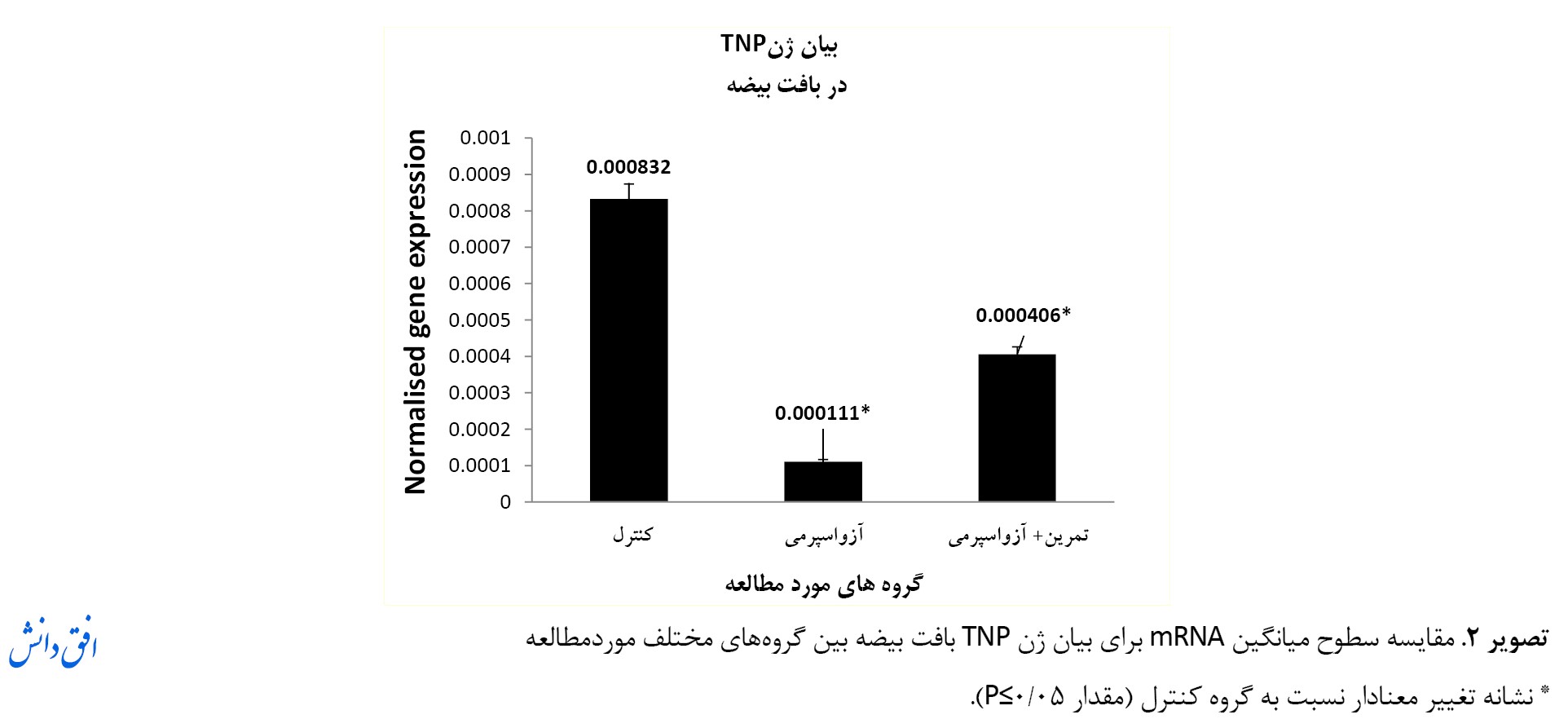
نتایج بررسی آزمون تعقیبی توکی بیانگر آن است که هشت هفته تمرین هوازی شنا با شدت پایین موجب کاهش معنادار سطح بیان ژن TNP در گروه تمرین+آزواسپرمی نسبت به گروه کنترل سالم (104/93 درصد) و افزایش غیرمعنادار نسبت به گروه آزواسپرمی (265/76 درصد) شده است (به ترتیب 0/001=P=0/057، P) (تصویر شماره 2).
References
1.Ernst C, Eling N, Martinez-Jimenez CP, Marioni JC, Odom DT. Staged developmental mapping and X chromosome transcriptional dynamics during mouse spermatogenesis. Nature Communications. 2019; 10(1):1251. [DOI:10.1038/s41467-019-09182-1] [PMID] [PMCID]
2.Ni FD, Hao SL, Yang WX. Multiple signaling pathways in Sertoli cells: Recent Findings in spermatogenesis. Cell Death & Disease. 2019; 10(8):541. [DOI:10.1038/s41419-019-1782-z] [PMID] [PMCID]
3.Griswold MD. Spermatogenesis: The commitment to meiosis. Physiological Reviews. 2016; 96(1):1-17. [DOI:10.1152/physrev.00013.2015] [PMID] [PMCID]
4.Gutierrez K, Glanzner WG, Chemeris RO, Rigo ML, Comim FV, Bordignon V, et al. Gonadotoxic effects of busulfan in two strains of mice. Reproductive Toxicology. 2016; 59:31-9. [DOI:10.1016/j.reprotox.2015.09.002] [PMID]
5.Khanehzad M, Abolhasani F, Koruji SM, Ragerdi Kashani I, Aliakbari F. [The roles of Sertoli cells in fate determinations of spermatogonial stem cells (Persian)]. Tehran University Medical Journal. 2016; 73(12):878-87. http://tumj.tums.ac.ir/article-1-7253-en.html
6.Cioppi F, Casamonti E, Krausz C. Age-dependent de novo mutations during spermatogenesis and their consequences. Advances in Experimental Medicine and Biology. 2019; 1166:29-46. [DOI:10.1007/978-3-030-21664-1_2] [PMID]
7.Fahnenstich J, Nandy A, Milde-Langosch K, Schneider-Merck T, Walther N, Gellersen B. Promyelocytic Leukaemia Zinc Finger protein (PLZF) is a glucocorticoid- and progesterone-induced transcription factor in human endometrial stromal cells and myometrial smooth muscle cells. Molecular Human Reproduction. 2003; 9(10):611-23. [DOI:10.1093/molehr/gag080] [PMID]
8.Wang X, Wang J, Zhang L. Characterization of atypical acute promyelocytic leukaemia: Three cases report and literature review. Medicine (Baltimore). 2019; 98(19):e15537. [DOI:10.1097/MD.0000000000015537] [PMID] [PMCID]
9.Fayomi AP, Orwig KE. Spermatogonial stem cells and spermatogenesis in mice, monkeys and men. Stem Cell Research. 2018; 29:207-14. [DOI:10.1016/j.scr.2018.04.009] [PMID] [PMCID]
10.Savage AK, Constantinides MG, Han J, Picard D, Martin E, Li B, et al. The transcription factor PLZF directs the effector program of the NKT cell lineage. Immunity. 2008; 29(3):391-403. [DOI:10.1016/j.immuni.2008.07.011] [PMID] [PMCID]
11.Jin Y, Nenseth HZ, Saatcioglu F. Role of PLZF as a tumor suppressor in prostate cancer. Oncotarget. 2017; 8(41):71317-24. [DOI:10.18632/oncotarget.19813] [PMID] [PMCID]
12.Liu TM, Lee EH, Lim B, Shyh-Chang N. Concise review: Balancing stem cell self-renewal and differentiation with PLZF. Stem Cells. 2016; 34(2):277-87. [DOI:10.1002/stem.2270] [PMID]
13.Meistrich ML, Mohapatra B, Shirley CR, Zhao M. Roles of transition nuclear proteins in spermiogenesis. Chromosoma. 2003; 111(8):483-8. [DOI:10.1007/s00412-002-0227-z] [PMID]
14.Jedrzejczak P, Kempisty B, Bryja A, Mostowska M, Depa-Martynow M, Pawelczyk L, et al. Quantitative assessment of transition proteins 1, 2 spermatid-specific linker histone H1-like protein transcripts in spermatozoa from normozoospermic and asthenozoospermic men. Archives of Andrology. 2007; 53(4):199-205. [DOI:10.1080/01485010701426430] [PMID]
15.Meistrich ML. Effects of chemotherapy and radiotherapy on spermatogenesis in humans. Fertility and Sterility. 2013; 100(5):1180-6. [DOI:10.1016/j.fertnstert.2013.08.010] [PMID] [PMCID]
16.Torma F, Koltai E, Nagy E, Mosaferi Ziaaldini M, Posa A, Koch LG, et al. Exercise increases markers of spermatogenesis in rats selectively bred for low running capacity. PLoS One. 2014; 9(12):e114075. [DOI:10.1371/journal.pone.0114075] [PMID] [PMCID]
17.Mohaqiq M, Movahedin M, Mazaheri Z, Amirjannati N. Successful human spermatogonial stem cells homing in recipient mouse testis after in vitro transplantation and organ culture. Cell Journal. 2019; 20(4):513-20. [DOI:10.26226/morressier.5af300b3738ab10027aa9b14] [PMID] [PMCID]
18.Chen H, Tang QL, Wu XY, Xie LC, Lin LM, Ho GY, et al. Differentiation of human umbilical cord mesenchymal stem cells into germ-like cells in mouse seminiferous tubules. Molecular Medicine Reports. 2015; 12(1):819-28. [DOI:10.3892/mmr.2015.3528] [PMID] [PMCID]
19.Bagheri Hamzian Olya J, Khadem Ansari MH, Yaghmaei P. [The effect of endurance running activities on Prolactin, Testosterone and DHEA-S levels (Persian)]. The Journal of Urmia University of Medical Sciences. 2011; 21(5):391-7. http://umj.umsu.ac.ir/article-1-828-en.html
20.Taher Z, Hamednia M, Haghighi H. [Investigation of effect of one session moderate and heavy resistance exercise on acute and delayed responses of leptin, insulin, cortisol, testosterone and 24- hour energy expenditure in healthy men (Persian)]. Iranian Journal of Endocrinology & Metabolism. 2011; 13(1):67-73. http://ijem.sbmu.ac.ir/article-1-871-fa.html
21.Urhausen A, Kullmer T, Kindermann W. A 7-week follow up study of the behavior of testosterone and cortisol during the competition period in rowers. European Journal of Applied Physiology and Occupational Physiology. 1987; 56(5):528-33. [DOI:10.1007/BF00635365] [PMID]
22.Manna I, Jana K, Samanta PK. Effect of intensive exercise-induced testicular gametogenic and steroidogenic disorders in mature male Wistar strain rats: A correlative approach to oxidative stress. Acta Physiologica Scandinavica. 2003; 178(1):33-40. [DOI:10.1046/j.1365-201X.2003.01095.x] [PMID]
23.Vaamonde D, Garcia-Manso JM, Hackney AC. Impact of physical activity and exercise on male reproductive potential: A new assessment questionnaire. Revista Andaluza de Medicina del Deporte. 2017; 10(2):79-93. [DOI:10.1016/j.ramd.2016.11.017] [PMID] [PMCID]
24.Jóźków P, Rossato M. The impact of intense exercise on semen quality. American Journal of Men’s Health. 2017; 11(3):654-62. [DOI:10.1177/1557988316669045] [PMID] [PMCID]
25.National Research Council, Division on Earth and Life Studies, Institute for Laboratory Animal Research, Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide to the care and use of experimental animals. 2nd ed. Ottawa: Canadian Council on Animal Care Ottawa Pub; 1993. https://www.ncbi.nlm.nih.gov/books/NBK54050/
26.Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Research. 2001; 29(9):e45. [DOI:10.1093/nar/29.9.e45] [PMID] [PMCID]
27.Costoya JA, Hobbs RM, Barna M, Cattoretti G, Manova K, Sukhwani M, et al. Essential role of Plzf in maintenance of spermatogonial stem cells. Nature Genetics. 2004; 36(6):653-9. [DOI:10.1038/ng1367] [PMID]
28.Choi WI, Kim MY, Jeon BN, Koh DI, Yun CO, Li Y, et al. Role of Promyelocytic Leukemia Zinc Finger (PLZF) in cell proliferation and cyclin-dependent kinase inhibitor 1A (p21WAF/CDKN1A) gene repression. The Journal of Biological Chemistry. 2014; 289(27):18625-40. [DOI:10.1074/jbc.M113.538751] [PMID] [PMCID]
29.Hsu YH, Chen YC, Chen TH, Sue YM, Cheng TH, Chen JR, et al. Far-infrared therapy induces the nuclear translocation of PLZF which inhibits VEGF-induced proliferation in human umbilical vein endothelial cells. PLoS One. 2012; 7(1):e30674. [DOI:10.1371/journal.pone.0030674] [PMID] [PMCID]
30.Kemi OJ, Wislff U. Mechanisms of exercise-induced improvements in the contractile apparatus of the mammalian myocardium. Acta Physiologica (Oxf). 2010; 199(4):425-39. [DOI:10.1111/j.1748-1716.2010.02132.x] [PMID]
31.Farup J, Sørensen H, Kjølhede T. Similar changes in muscle fiber phenotype with differentiated consequences for rate of force development: Endurance versus resistance training. Human Movement Science. 2014; 34:109-19. [DOI:10.1016/j.humov.2014.01.005] [PMID]
32.Snijders T, Nederveen JP, Joanisse S, Leenders M, Verdijk LB, van Loon LJC, et al. Muscle fibre capillarization is a critical factor in muscle fibre hypertrophy during resistance exercise training in older men. Journal of Cachexia, Sarcopenia and Muscle. 2017; 8(2):267-76. [DOI:10.1002/jcsm.12137] [PMID] [PMCID]
33.Kingsley JD, Figueroa A. Acute and training effects of resistance exercise on heart rate variability. Clinical Physiology and Functional Imaging. 2016; 36(3):179-87. [DOI:10.1111/cpf.12223] [PMID]
34.Isner-Horobeti ME, Dufour SP, Vautravers P, Geny B, Coudeyre E, Richard R. Eccentric exercise training: Modalities, applications and perspectives. Sports Medicine. 2013; 43(6):483-512. [DOI:10.1007/s40279-013-0052-y] [PMID]
35.Shulman GI, Rothman DL, Jue T, Stein P, DeFronzo RA, Shulman RG. Quantitation of muscle glycogen synthesis in normal subjects and subjects with non-insulin-dependent diabetes by 13C nuclear magnetic resonance spectroscopy. The New England Journal of Medicine. 1990; 322(4):223-8. [DOI:10.1056/NEJM199001253220403] [PMID]
36.Pozefsky T, Tancredi RG, Moxley RT, Dupre J, Tobin JD. Effects of brief starvation on muscle amino acid metabolism in nonobese man. The Journal of Clinical Investigation. 1976; 57(2):444-9. [DOI:10.1172/JCI108295] [PMID] [PMCID]
متن کامل: (2233 مشاهده)
مقدمه
اسپرماتوژنز فرایندی است که با تکثیر و تمایز سلولهای بنیادی اسپرماتوگونی صورت میپذیرد [1]. این سلولها روی غشای پایه لولههای اسپرمساز واقعشدهاند و سلولهای سرتولی آنها را احاطه کردهاند [2]. این مجموعه، محیطی را فراهم میآورد که باعث عملکرد و بقای اسپرم میشود [3]. هرگونه تغییر در این محیط باعث اختلال در اسپرماتوژنز میشودکه به نوبه خود میتواند باعث ناباروری موقت یا دائم شود [4]. سلولهای بنیادی اسپرماتوگونی پایه و اساس روند اسپرمزایی و باروری جنس مذکر را تشکیل میدهند [5]. از میان انواع مختلف سلولهای بنیادی که در یک موجود زنده یافت میشوند، سلولهای بنیادی اسپرماتوگونی از نظر اینکه قادر به انتقال اطلاعات وراثتی به نسل بعد از خود هستند، حائز اهمیتاند؛ بنابراین این سلولها را میتوان به عنوان منبع باارزشی به منظر تحقیقات مختلف مورد استفاده قرار داد [4، 5]. تکثیر و تمایز سلولهای اسپرماتوگونی، کلید اصلی و اولیه در روند اسپرمزایی و حفظ باروری مردان هستند [6].
PLZF به عنوان یکی از مارکرهای شناختهشده سلولهای بنیادی اسپرماتوگونی است که برای حفظ و توسعه سلولهای بنیادی اسپرماتوگونی در کشت ضروری است [7]. PLZF توسط سلولهای سرتولی تولید و ترشح میشود و زیرمجموعهای از سلولهای اسپرماتوگونی، رسپتور آن را بیان میکنند [8]. این فاکتور باعث حفظ و تکثیر سلولهای بنیادی اسپرماتوگونی در شرایط آزمایشگاهی میشود [9]. در بیضه PLZF محدود به اسپرماتوگونیاهای SSCهاست. مطالعات نشان داده که پس از پیوند SSCها از موشهای بدون PLZF، در موش گیرنده روند اسپرماتوژنز از سر گرفته نمیشود [10]؛ بنابراین یکی از نقشهای احتمالی برای PLZF میتواند حفظ موقعیت غیرتمایزی باشد [11]. PLZF به عنوان مارکر اساسی سطحی سلولهای پروژنیتور / بنیادی اسپرماتوگونی محسوب میشود [12].
نوع دیگر نوکلئوپروتئینهای اسپرمی، پروتئینهایی هستند که تحت عنوان پروتئینهای هستهای گذرا نامگذاری میشوند [13]. این پروتئینهای گذرا حدود 90 درصد از پروتئینهای اصلی کروماتین را طی مراحل حذف هیستونها و جایگزینی پروتئینهای گذرا، تشکیل میدهد [4]. مطالعات آزمایشگاهی گزارش کردهاندکه عملکرد احتـمالی پروتئین TNP شامل آزادسازی DNA در ذرات هستهای نوکلئوزومها، کاهش دمای ذوب DNA و تحریک فعالیت توپوایزومر از نوع 1 است [14]. مشخص شده است که در مردان نابارور اسپرماتوزوها تغییرات هستهای زیادی شامل ساختار غیرطبیعی کروماتین، حذفهای کوچک کروموزومی، آنیوپلوئیدی و شکستهای رشتهای DNA دارند [15].
نتایج مطالعات بیانگر آن است که افزایش بیان و سیگنالینگ PLZF و TNP در یک استراتژی درمانی امیدوارکننده برای درمان آزواسپرمیاست [16]. در این راستا، عوامل قابل اصلاحی مانند فعالیت بدنی وجود دارند که به پیشگیری و درمان این بیماری از طریق تنظیم و تعدیل ژنهای مؤثر در باروری کمک میکنند [17]، چراکه ناباروری ناشی از عدم تحرک که در افراد مبتلا به آزواسپرمی مشاهده میشود، از نگرانیهای قابل توجه محافل پزشکی محسوب میشوند [18]. اما اینکه چه نوع فعالیت ورزشی و از طریق چه مکانیسمهای سلولی و مولکولی میتواند بهترین اثربخشی را داشته باشد، هنوز به طور کامل و دقیق شناخته نشده است. مطالعات نشان میدهد که تمرین هوازی با شدت پایین میتواند با ایجاد مکانیسم حفاظتی منجر به کاهش بیان سایتوکینهای التهابی، استرس اکسیداتیو در بافت بیضه، التهاب سیستمیک و در نتیجه بهبود پاسخهای ایمنی شود [19]. از میان تمرینهای هوازی، تمرین هوازی شنا با شدت پایین از جمله تمریناتی است که در شرایط مختلف فیزیولوژیک، ایمن و قابل استفاده بوده و به دلیل عدم تحمل وزن در آب نسبت به ورزشهای غیرآبی در اکثر مطالعات فیزیولوژیکی، بیوشیـمیایی و واکنشهای مولکولی به کار میرود [20]. فعالیت ورزشی آرام تا متوسط به علت افزایش جریان خون بهتدریج سبب بهبود فعالیت متابولیکی میشود، اما فعالیت شدید به دلیل تغییر جهت جریان خون به سمت ماهیچههای در حال فعالیت سبب کاهش آن میشود [20]. کاهش فعالیت بدنی میتواند باعث کاهش مقدار هورمونهای جنسی، اسپرمزایی و باروری و نیز کوچکتر شدن بیضه و کاهش مقدار منی شود [21]. در مطالعه فرنس و همکاران گزارش شد که متعاقب 12 هفته تمرین هوازی با شدت متوسط نشانگرهای اسپرماتوژنز از قبیل سطح PGC-1α و PLZF در موشهای صحرایی بهبود یافتند [22]. در مطالعه مروریوماندو و همکاران اینطور گزارش شده که بعد از یک دوره فعالیت ورزشی هوازی با شدت پایین و متوسط، سطح بیماری آزواسپرمی از طریق تعدیل ژنهای درگیری در این بیماری و کاهش سطح استرس اکسداتیو و التهاب در این بیماران، کیفیت منی و باروری افزایش مییابد [23]. در این راستا نتایج مطالعات نشان داد که تمرین با شدت بالا میتواند منجر به تغییرات منفی و مثبت در ژنهای مؤثر در باروری اسپرم از قبیل PLZF و TNP داشته باشد [24].
مکانیسمهای محتملی نیز پیشنهاد شده است، اما نتایج مطالعات در مورد ارتباط بین فعالیت بدنی و میزان بیماری آزواسپرمی اندک و متناقض است. بنابراین با توجه به اهمیت پیشگیری از عوامل بروز بیماری آزواسپرمی و نیز فقدان اطلاعات لازم و مکفی در خصوص تأثیر تمرینهای ورزشی بر سطح بیان ژن PLZF و TNP در بیماری آزواسپرمی، مطالعه حاضر با هدف بررسی تأثیر هشت هفته تمرین شنا با شدت پایین بر بیان ژن PLZF و TNP در موشهای صحرایی مدل آزواسپرمی انجام گرفت.
مواد و روشها
در این مطالعه تجربی پانزده سر موش صحرایی نر بالغ نژاد ویستار شش تا هشتهفتهای با میانگین وزنی 15/62±202/85 گرم از انستیتو پاستور خریداری شدند. حیوانات در محیطی با میانگین دمای 1/4±22 درجه سانتیگراد، رطوبت 55 درصد و چرخه روشنایی تاریکی 12:12 ساعت در قفسهای مخصوص از جنس پلیکربنات نگهداری شدند. نگهداری حیوانات مطابق با راهنمای انستیتوی بینالمللی سلامت بود و پروتکلهای این مطالعه با رعایت اصول اعلامیه هلسینکی و ضوابط اخلاق پزشکی انجام شد [25]. حیوانات از غذای پلت و آب که به صورت آزاد در اختیار قرار میگرفت، تیمار شدند. غذای مصرفی حیوانات با توجه به وزنکشی هفتگی به میزان 10 گرم به ازای هر 100 گرم وزن بدن در اختیار حیوان قرار داشت.
به منظور ایجاد مدل آزواسپپرمی، ابتدا داروی بوسولفان با دُز 40 میلیگرم بر کیلوگرم وزن بدن موشهای صحرایی به صورت داخل صفاقی برای هر موش صحرایی تزریق شد. پس از گذشت یک ماه از القای مدل در هر گروه، موشها به صورت تصادفی به سه گروه کنترل سالم (پنج سر)، آزواسپرمی (پنج سر)، تمرین+آزواسپرمی (پنج سر) تقسیم شدند [5، 4]. گروه آزواسپرمی، یک ماه بعد از ایجاد مدل تا پایان مطالعه (مدت هشت هفته) باقی ماندند و گروه کنترل سالم به مدت هشت هفته نگهداری شدند و گروه تمرین+آزواسپرمی، یک ماه بعد از ایجاد موشهای آزواسپرمی به مدت هشت هفته به انجام تمرین شنا پرداختند.
موشهای صحراییگروههای تمرین+آزواسپرمی، قبل از شروع پروتکل اصلی، به مدت یک هفته (پنج روز) هر بار به مدت مدت 20 دقیقه به منظورآشناییها با آب و کاهش استرس شنا و سازگاری با شرایط تمرینی، در داخل استخر آب قرار میگرفتند. سپس پنج روز در هفته تا پایان دوره تحقیق در یک مخزن آب به ابعاد 50×50×100 سانتیمتری با درجه حرارت 30-32 درجه سانتیگراد در طی هشت هفته به شنا پرداختند. مدتزمان تمرین در آب، روزانه 30 دقیقه تا پایان مدت تمرین بود.
جهت حذف اثر حاد تمرین، نمونهبردای از حیوانات پس از 48 ساعت بعد از آخرین برنامه تمرینی شنا انجام گرفت. بدین منظور ابتدا حیوانات با استفاده از تزریق صفاقی کتامین (30-50 میلیگرم بر کیلوگرم) و زایلازین (3-5 میلیگرم بر کیلوگرم) بیهوش و سپس کشته شدند و پس از کشتار بافتهای پیوندشده مربوط به ناحیه بیضه جهت بررسی بافتشناسی و مطالعات ژنی مورد ارزیابی قرار گرفتند. برای این منظور نمونههای بافتی به فرمالین 10 درصد و نمونههای مربوط به بررسی بیان ژن به تانک ازت منتقل شدند.
برای بررسی بیان ژنهای PLZF و TNP در هر گروه بررسی بافتها با تکنیک PCR Real Time استفاده شد. ابتدا طراحی پرایمر انجام شد و سپس RNA کل از بافتها استخراج شد و به cDNA تبدیل شد. سپس cDNA به روش PCR تکثیر شده و از تکنیک RT-qPCR جهت تأیید بیان ژنهای موردمطالعه به صورت کمی استفاده شد. برای این منظور ابتدا با استفاده از محلول کیازول، RNA کل سلولها طبق پروتکل سیناژن استخراج شد و جهت اطمینان از آلودگی با DNA ژنومیک، در معرض DNase IFermentas قرار گرفت. علاوه بر این، جهت ارزیابی یکپارچگی RNA استخراج شده از ژل الکتروفورز استفاده شد.
جهت استخراج RNA ابتدا به بافت بیضه 300-200 لاندا کیازول اضافه شد و به مدت 24 ساعت آن در دمای منهای 80 قرار گرفت. پس از 24 ساعت پلاک موجود در کرایوتیوب در حالت نیمهانجماد توسط سرسمپلر خرد و سپس مقدار کمی از آن، پیپتاژ شد. سپس به نمونه حدود 100 لاندا کلروفرم اضافه شد تا سلولها لیز شود. این محلول حدود 1 دقیقه باید با سلولها در تماس بود.
پس از 1 دقیقه محلول با دور 12 هزار به مدت 10 دقیقه سانتریفیوژ شد. پس از سانتریفیوژ محلول به سه فاز تقسیم شد: قسمت بالایی لوله که شفاف و حاوی RNA بود، قسمت وسطی لوله که سفیدرنگ و حاوی بافت لیزشده بود و قسمت پایینی لوله که صورتی و حاوی کیازول بود. مایع شفاف قسمت بالایی لوله که حاوی RNA بود بهآرامی برداشته و در یک میکروتیوب DEPCشده، قرار داده شد. سپس 1 سیسی ایزوپروپانول روی RNA شفاف ریخته شد و به مدت 1 دقیقه با دست به هم زده شد. ایزوپروپرانول شفاف و RNA نیز شفاف است، اما وقتی این دو با هم مخلوط شوند مایع کدری را به وجود میآورند. پس از افزودن ایزوپروپرانول نمونهها در سانتریفیوژ با دور 12 هزار به مدت 10 دقیقه قرار داده شدند. پس از خارج کردن از سانتریفیوژ مایع رویی تخلیه و به آن 1 سیسی الکل 70 درصد اضافه شد. پس از Vortex کردن، مخلوط در سانتریفیوژ به مدت 10 دقیقه با دور 7500 قرار گرفت. سپس مایع رویی با سمپلر تخلیه شد و سپس پلاک در داخل میکروتیوب خشک شد. به منظور حل کردن RNA به میزان 20 لاندا آب مقطر 60 درجه روی پلاک داخل میکروتیوب ریخته شد. سپس کمی با سرسمپلر پیپتاژ و به مدت 5 دقیقه روی صفحه 60 درجه قرار داده شد.
همچنین جهت تهیه cDNA تکرشتهای از پرایمر OligodtMWG-Biotech, Germany و آنزیم نسخهبرداری معکوس (شرکت فرمنتاز "Fermentas") استفاده شد و برای این کار طبق دستورالعمل شرکت سازنده عمل شد. هر واکنش PCR با استفاده از PCR master mixApplied Biosystems و SYBER Green در دستگاه Applied Biosystems, Sequences DetectionSystems. Foster City, CA (ABI Step One) طبق پروتکل شرکت سازنده انجام گرفت. چهل سیکل برای هر چرخه Real-Time PCR در نظر گرفته شد و دماهای هر سیکل شامل 94 درجه سانتیگراد برای 20 ثانیه، 60-58 درجه سانتیگراد برای 30 ثانیه و 72 درجه سانتیگراد برای 30 ثانیه تنظیم شدند. نمودار Melting جهت بررسی صحت واکنشهای PCR ترسیم شد و به صورت اختصاصی برای هر ژن استفاده شد و در هربار واکنش به همراه نمودار کنترل منفی، جهت بررسی وجود آلودگی در هر واکنش مورد ارزیابی قرار گرفت.
نسبت بیان ژنهای موردبررسی در این مطالعه، با روش مقایسهای چرخه آستانه مورد ارزیابی قرار گرفتند. با استفاده از قرار دادن دادهها در فرمول شماره 1:
.jpg)
منحنی استاندارد اختصاصی هر ژن با استفاده از حداقل پنج غلظت لگاریتمی به ترتیب رقیقشونده از کنترل مثبت هر ژن رسم شد. میزان بیان ژن هدف با ژن مرجع نرمالیز شده و بیان ژنهای گروه سالم به عنوان کالیبراتور در نظر گرفته شد.
در فرمول شماره 2 E معرف Efficiency است و با استفاده از رسم منحنی استاندارد برای ژن به دست میآید [26].

بعد از تحلیل آزمایشگاهی نمونههای بافتی، برای توصیف کمی دادهها از شاخصهای آمار توصیفی شامل میانگین و انحراف استاندارد و آمار استنباطی استفاده شد. ابتدا جهت تعیین طبیعی بودن توزیع دادهها از آزمون شاپیرو ویلک و برای تعیین تجانس واریانس از آزمون لون استفاده شد. سپس با توجه به طبیعی بودن نحوه توزیع دادهها از آزمون پارامتریک شامل آزمون تحلیل واریانس یکطرفه و آزمون تعقیبی توکی در سطح معناداری 0/05≥P برای بررسی تغییرات بیان ژن PLZF و TNP استفاده شد. برای انجام کلیه امور آماری از نرمافزار SPSS نسخه 23 استفاده شد و برای رسم نمودار از نرمافزار اکسل استفاده شد.
یافتهها
جدول شماره 1، میانگین وزن موشهای صحرایی درگروههای مختلف موردمطالعه را نشان میدهد.

نتایج آزمون تحلیل واریانس یکطرفه نشان داد تفاوت معناداری در وزن موشهای صحرایی در گروههای مختلف موردمطالعه وجود ندارد (0/05≤P).
نتایج آزمون تعقیبی توکی نشان داد هشت هفته تمرین هوازی شنا با شدت پایین موجب کاهش معنادار سطح بیان ژن PLZF در گروه تمرین+آزواسپرمی نسبت به گروه کنترل سالم (125/42 درصد) و افزایش غیرمعنادار نسبت به گروه آزواسپرمی (42/47 درصد) شده است (به ترتیب 0/001=P=0/06 ،P) (تصویر شماره 1).
اسپرماتوژنز فرایندی است که با تکثیر و تمایز سلولهای بنیادی اسپرماتوگونی صورت میپذیرد [1]. این سلولها روی غشای پایه لولههای اسپرمساز واقعشدهاند و سلولهای سرتولی آنها را احاطه کردهاند [2]. این مجموعه، محیطی را فراهم میآورد که باعث عملکرد و بقای اسپرم میشود [3]. هرگونه تغییر در این محیط باعث اختلال در اسپرماتوژنز میشودکه به نوبه خود میتواند باعث ناباروری موقت یا دائم شود [4]. سلولهای بنیادی اسپرماتوگونی پایه و اساس روند اسپرمزایی و باروری جنس مذکر را تشکیل میدهند [5]. از میان انواع مختلف سلولهای بنیادی که در یک موجود زنده یافت میشوند، سلولهای بنیادی اسپرماتوگونی از نظر اینکه قادر به انتقال اطلاعات وراثتی به نسل بعد از خود هستند، حائز اهمیتاند؛ بنابراین این سلولها را میتوان به عنوان منبع باارزشی به منظر تحقیقات مختلف مورد استفاده قرار داد [4، 5]. تکثیر و تمایز سلولهای اسپرماتوگونی، کلید اصلی و اولیه در روند اسپرمزایی و حفظ باروری مردان هستند [6].
PLZF به عنوان یکی از مارکرهای شناختهشده سلولهای بنیادی اسپرماتوگونی است که برای حفظ و توسعه سلولهای بنیادی اسپرماتوگونی در کشت ضروری است [7]. PLZF توسط سلولهای سرتولی تولید و ترشح میشود و زیرمجموعهای از سلولهای اسپرماتوگونی، رسپتور آن را بیان میکنند [8]. این فاکتور باعث حفظ و تکثیر سلولهای بنیادی اسپرماتوگونی در شرایط آزمایشگاهی میشود [9]. در بیضه PLZF محدود به اسپرماتوگونیاهای SSCهاست. مطالعات نشان داده که پس از پیوند SSCها از موشهای بدون PLZF، در موش گیرنده روند اسپرماتوژنز از سر گرفته نمیشود [10]؛ بنابراین یکی از نقشهای احتمالی برای PLZF میتواند حفظ موقعیت غیرتمایزی باشد [11]. PLZF به عنوان مارکر اساسی سطحی سلولهای پروژنیتور / بنیادی اسپرماتوگونی محسوب میشود [12].
نوع دیگر نوکلئوپروتئینهای اسپرمی، پروتئینهایی هستند که تحت عنوان پروتئینهای هستهای گذرا نامگذاری میشوند [13]. این پروتئینهای گذرا حدود 90 درصد از پروتئینهای اصلی کروماتین را طی مراحل حذف هیستونها و جایگزینی پروتئینهای گذرا، تشکیل میدهد [4]. مطالعات آزمایشگاهی گزارش کردهاندکه عملکرد احتـمالی پروتئین TNP شامل آزادسازی DNA در ذرات هستهای نوکلئوزومها، کاهش دمای ذوب DNA و تحریک فعالیت توپوایزومر از نوع 1 است [14]. مشخص شده است که در مردان نابارور اسپرماتوزوها تغییرات هستهای زیادی شامل ساختار غیرطبیعی کروماتین، حذفهای کوچک کروموزومی، آنیوپلوئیدی و شکستهای رشتهای DNA دارند [15].
نتایج مطالعات بیانگر آن است که افزایش بیان و سیگنالینگ PLZF و TNP در یک استراتژی درمانی امیدوارکننده برای درمان آزواسپرمیاست [16]. در این راستا، عوامل قابل اصلاحی مانند فعالیت بدنی وجود دارند که به پیشگیری و درمان این بیماری از طریق تنظیم و تعدیل ژنهای مؤثر در باروری کمک میکنند [17]، چراکه ناباروری ناشی از عدم تحرک که در افراد مبتلا به آزواسپرمی مشاهده میشود، از نگرانیهای قابل توجه محافل پزشکی محسوب میشوند [18]. اما اینکه چه نوع فعالیت ورزشی و از طریق چه مکانیسمهای سلولی و مولکولی میتواند بهترین اثربخشی را داشته باشد، هنوز به طور کامل و دقیق شناخته نشده است. مطالعات نشان میدهد که تمرین هوازی با شدت پایین میتواند با ایجاد مکانیسم حفاظتی منجر به کاهش بیان سایتوکینهای التهابی، استرس اکسیداتیو در بافت بیضه، التهاب سیستمیک و در نتیجه بهبود پاسخهای ایمنی شود [19]. از میان تمرینهای هوازی، تمرین هوازی شنا با شدت پایین از جمله تمریناتی است که در شرایط مختلف فیزیولوژیک، ایمن و قابل استفاده بوده و به دلیل عدم تحمل وزن در آب نسبت به ورزشهای غیرآبی در اکثر مطالعات فیزیولوژیکی، بیوشیـمیایی و واکنشهای مولکولی به کار میرود [20]. فعالیت ورزشی آرام تا متوسط به علت افزایش جریان خون بهتدریج سبب بهبود فعالیت متابولیکی میشود، اما فعالیت شدید به دلیل تغییر جهت جریان خون به سمت ماهیچههای در حال فعالیت سبب کاهش آن میشود [20]. کاهش فعالیت بدنی میتواند باعث کاهش مقدار هورمونهای جنسی، اسپرمزایی و باروری و نیز کوچکتر شدن بیضه و کاهش مقدار منی شود [21]. در مطالعه فرنس و همکاران گزارش شد که متعاقب 12 هفته تمرین هوازی با شدت متوسط نشانگرهای اسپرماتوژنز از قبیل سطح PGC-1α و PLZF در موشهای صحرایی بهبود یافتند [22]. در مطالعه مروریوماندو و همکاران اینطور گزارش شده که بعد از یک دوره فعالیت ورزشی هوازی با شدت پایین و متوسط، سطح بیماری آزواسپرمی از طریق تعدیل ژنهای درگیری در این بیماری و کاهش سطح استرس اکسداتیو و التهاب در این بیماران، کیفیت منی و باروری افزایش مییابد [23]. در این راستا نتایج مطالعات نشان داد که تمرین با شدت بالا میتواند منجر به تغییرات منفی و مثبت در ژنهای مؤثر در باروری اسپرم از قبیل PLZF و TNP داشته باشد [24].
مکانیسمهای محتملی نیز پیشنهاد شده است، اما نتایج مطالعات در مورد ارتباط بین فعالیت بدنی و میزان بیماری آزواسپرمی اندک و متناقض است. بنابراین با توجه به اهمیت پیشگیری از عوامل بروز بیماری آزواسپرمی و نیز فقدان اطلاعات لازم و مکفی در خصوص تأثیر تمرینهای ورزشی بر سطح بیان ژن PLZF و TNP در بیماری آزواسپرمی، مطالعه حاضر با هدف بررسی تأثیر هشت هفته تمرین شنا با شدت پایین بر بیان ژن PLZF و TNP در موشهای صحرایی مدل آزواسپرمی انجام گرفت.
مواد و روشها
در این مطالعه تجربی پانزده سر موش صحرایی نر بالغ نژاد ویستار شش تا هشتهفتهای با میانگین وزنی 15/62±202/85 گرم از انستیتو پاستور خریداری شدند. حیوانات در محیطی با میانگین دمای 1/4±22 درجه سانتیگراد، رطوبت 55 درصد و چرخه روشنایی تاریکی 12:12 ساعت در قفسهای مخصوص از جنس پلیکربنات نگهداری شدند. نگهداری حیوانات مطابق با راهنمای انستیتوی بینالمللی سلامت بود و پروتکلهای این مطالعه با رعایت اصول اعلامیه هلسینکی و ضوابط اخلاق پزشکی انجام شد [25]. حیوانات از غذای پلت و آب که به صورت آزاد در اختیار قرار میگرفت، تیمار شدند. غذای مصرفی حیوانات با توجه به وزنکشی هفتگی به میزان 10 گرم به ازای هر 100 گرم وزن بدن در اختیار حیوان قرار داشت.
به منظور ایجاد مدل آزواسپپرمی، ابتدا داروی بوسولفان با دُز 40 میلیگرم بر کیلوگرم وزن بدن موشهای صحرایی به صورت داخل صفاقی برای هر موش صحرایی تزریق شد. پس از گذشت یک ماه از القای مدل در هر گروه، موشها به صورت تصادفی به سه گروه کنترل سالم (پنج سر)، آزواسپرمی (پنج سر)، تمرین+آزواسپرمی (پنج سر) تقسیم شدند [5، 4]. گروه آزواسپرمی، یک ماه بعد از ایجاد مدل تا پایان مطالعه (مدت هشت هفته) باقی ماندند و گروه کنترل سالم به مدت هشت هفته نگهداری شدند و گروه تمرین+آزواسپرمی، یک ماه بعد از ایجاد موشهای آزواسپرمی به مدت هشت هفته به انجام تمرین شنا پرداختند.
موشهای صحراییگروههای تمرین+آزواسپرمی، قبل از شروع پروتکل اصلی، به مدت یک هفته (پنج روز) هر بار به مدت مدت 20 دقیقه به منظورآشناییها با آب و کاهش استرس شنا و سازگاری با شرایط تمرینی، در داخل استخر آب قرار میگرفتند. سپس پنج روز در هفته تا پایان دوره تحقیق در یک مخزن آب به ابعاد 50×50×100 سانتیمتری با درجه حرارت 30-32 درجه سانتیگراد در طی هشت هفته به شنا پرداختند. مدتزمان تمرین در آب، روزانه 30 دقیقه تا پایان مدت تمرین بود.
جهت حذف اثر حاد تمرین، نمونهبردای از حیوانات پس از 48 ساعت بعد از آخرین برنامه تمرینی شنا انجام گرفت. بدین منظور ابتدا حیوانات با استفاده از تزریق صفاقی کتامین (30-50 میلیگرم بر کیلوگرم) و زایلازین (3-5 میلیگرم بر کیلوگرم) بیهوش و سپس کشته شدند و پس از کشتار بافتهای پیوندشده مربوط به ناحیه بیضه جهت بررسی بافتشناسی و مطالعات ژنی مورد ارزیابی قرار گرفتند. برای این منظور نمونههای بافتی به فرمالین 10 درصد و نمونههای مربوط به بررسی بیان ژن به تانک ازت منتقل شدند.
برای بررسی بیان ژنهای PLZF و TNP در هر گروه بررسی بافتها با تکنیک PCR Real Time استفاده شد. ابتدا طراحی پرایمر انجام شد و سپس RNA کل از بافتها استخراج شد و به cDNA تبدیل شد. سپس cDNA به روش PCR تکثیر شده و از تکنیک RT-qPCR جهت تأیید بیان ژنهای موردمطالعه به صورت کمی استفاده شد. برای این منظور ابتدا با استفاده از محلول کیازول، RNA کل سلولها طبق پروتکل سیناژن استخراج شد و جهت اطمینان از آلودگی با DNA ژنومیک، در معرض DNase IFermentas قرار گرفت. علاوه بر این، جهت ارزیابی یکپارچگی RNA استخراج شده از ژل الکتروفورز استفاده شد.
جهت استخراج RNA ابتدا به بافت بیضه 300-200 لاندا کیازول اضافه شد و به مدت 24 ساعت آن در دمای منهای 80 قرار گرفت. پس از 24 ساعت پلاک موجود در کرایوتیوب در حالت نیمهانجماد توسط سرسمپلر خرد و سپس مقدار کمی از آن، پیپتاژ شد. سپس به نمونه حدود 100 لاندا کلروفرم اضافه شد تا سلولها لیز شود. این محلول حدود 1 دقیقه باید با سلولها در تماس بود.
پس از 1 دقیقه محلول با دور 12 هزار به مدت 10 دقیقه سانتریفیوژ شد. پس از سانتریفیوژ محلول به سه فاز تقسیم شد: قسمت بالایی لوله که شفاف و حاوی RNA بود، قسمت وسطی لوله که سفیدرنگ و حاوی بافت لیزشده بود و قسمت پایینی لوله که صورتی و حاوی کیازول بود. مایع شفاف قسمت بالایی لوله که حاوی RNA بود بهآرامی برداشته و در یک میکروتیوب DEPCشده، قرار داده شد. سپس 1 سیسی ایزوپروپانول روی RNA شفاف ریخته شد و به مدت 1 دقیقه با دست به هم زده شد. ایزوپروپرانول شفاف و RNA نیز شفاف است، اما وقتی این دو با هم مخلوط شوند مایع کدری را به وجود میآورند. پس از افزودن ایزوپروپرانول نمونهها در سانتریفیوژ با دور 12 هزار به مدت 10 دقیقه قرار داده شدند. پس از خارج کردن از سانتریفیوژ مایع رویی تخلیه و به آن 1 سیسی الکل 70 درصد اضافه شد. پس از Vortex کردن، مخلوط در سانتریفیوژ به مدت 10 دقیقه با دور 7500 قرار گرفت. سپس مایع رویی با سمپلر تخلیه شد و سپس پلاک در داخل میکروتیوب خشک شد. به منظور حل کردن RNA به میزان 20 لاندا آب مقطر 60 درجه روی پلاک داخل میکروتیوب ریخته شد. سپس کمی با سرسمپلر پیپتاژ و به مدت 5 دقیقه روی صفحه 60 درجه قرار داده شد.
همچنین جهت تهیه cDNA تکرشتهای از پرایمر OligodtMWG-Biotech, Germany و آنزیم نسخهبرداری معکوس (شرکت فرمنتاز "Fermentas") استفاده شد و برای این کار طبق دستورالعمل شرکت سازنده عمل شد. هر واکنش PCR با استفاده از PCR master mixApplied Biosystems و SYBER Green در دستگاه Applied Biosystems, Sequences DetectionSystems. Foster City, CA (ABI Step One) طبق پروتکل شرکت سازنده انجام گرفت. چهل سیکل برای هر چرخه Real-Time PCR در نظر گرفته شد و دماهای هر سیکل شامل 94 درجه سانتیگراد برای 20 ثانیه، 60-58 درجه سانتیگراد برای 30 ثانیه و 72 درجه سانتیگراد برای 30 ثانیه تنظیم شدند. نمودار Melting جهت بررسی صحت واکنشهای PCR ترسیم شد و به صورت اختصاصی برای هر ژن استفاده شد و در هربار واکنش به همراه نمودار کنترل منفی، جهت بررسی وجود آلودگی در هر واکنش مورد ارزیابی قرار گرفت.
نسبت بیان ژنهای موردبررسی در این مطالعه، با روش مقایسهای چرخه آستانه مورد ارزیابی قرار گرفتند. با استفاده از قرار دادن دادهها در فرمول شماره 1:
.jpg)
منحنی استاندارد اختصاصی هر ژن با استفاده از حداقل پنج غلظت لگاریتمی به ترتیب رقیقشونده از کنترل مثبت هر ژن رسم شد. میزان بیان ژن هدف با ژن مرجع نرمالیز شده و بیان ژنهای گروه سالم به عنوان کالیبراتور در نظر گرفته شد.
در فرمول شماره 2 E معرف Efficiency است و با استفاده از رسم منحنی استاندارد برای ژن به دست میآید [26].

بعد از تحلیل آزمایشگاهی نمونههای بافتی، برای توصیف کمی دادهها از شاخصهای آمار توصیفی شامل میانگین و انحراف استاندارد و آمار استنباطی استفاده شد. ابتدا جهت تعیین طبیعی بودن توزیع دادهها از آزمون شاپیرو ویلک و برای تعیین تجانس واریانس از آزمون لون استفاده شد. سپس با توجه به طبیعی بودن نحوه توزیع دادهها از آزمون پارامتریک شامل آزمون تحلیل واریانس یکطرفه و آزمون تعقیبی توکی در سطح معناداری 0/05≥P برای بررسی تغییرات بیان ژن PLZF و TNP استفاده شد. برای انجام کلیه امور آماری از نرمافزار SPSS نسخه 23 استفاده شد و برای رسم نمودار از نرمافزار اکسل استفاده شد.
یافتهها
جدول شماره 1، میانگین وزن موشهای صحرایی درگروههای مختلف موردمطالعه را نشان میدهد.

نتایج آزمون تحلیل واریانس یکطرفه نشان داد تفاوت معناداری در وزن موشهای صحرایی در گروههای مختلف موردمطالعه وجود ندارد (0/05≤P).
نتایج آزمون تعقیبی توکی نشان داد هشت هفته تمرین هوازی شنا با شدت پایین موجب کاهش معنادار سطح بیان ژن PLZF در گروه تمرین+آزواسپرمی نسبت به گروه کنترل سالم (125/42 درصد) و افزایش غیرمعنادار نسبت به گروه آزواسپرمی (42/47 درصد) شده است (به ترتیب 0/001=P=0/06 ،P) (تصویر شماره 1).
نتایج بررسی آزمون تعقیبی توکی بیانگر آن است که هشت هفته تمرین هوازی شنا با شدت پایین موجب کاهش معنادار سطح بیان ژن TNP در گروه تمرین+آزواسپرمی نسبت به گروه کنترل سالم (104/93 درصد) و افزایش غیرمعنادار نسبت به گروه آزواسپرمی (265/76 درصد) شده است (به ترتیب 0/001=P=0/057، P) (تصویر شماره 2).
بحث
در تحقیق حاضرتأثیر هشت هفته تمرین شنا با شدت پایین بر بیان ژن PLZF و TNP در موشهای مدل آزواسپرمی مورد بررسی قرار گرفت. از نتایج مهم تحقیق حاضر کاهش معنادار سطح بیان ژن PLZF و TNP موشهای صحرایی مدل آزواسپرمی نسبت به گروه سالم است. نتایج مطالعه حاضر با نتایج مطالعه برخی از محقین که در تحقیق خود اظهار داشتند بیماری آزواسپرمی منجر به تغییر بیان ژنهای درگیر در باروری از قبیل PLZF و TNPمیشود، همسوست [22، 23، 24]. PLZF و TNP از مارکرهای اساسی در حفظ و توسعه سلولهای بنیادی اسپرماتوگونی شناخته شدند [27].
نتایج تحقیقات نشان داد که درمردان نابارور اسپرماتوزوها تغییرات هستهای زیادی شامل ساختار غیرطبیعی کروماتین و شکستهای رشتهای DNA وجود دارد که منجر به تغییر در سطح بیان این ژن میشود [13]. این ژنها که در تکثیر و تمایز سلولهای بنیادی اسپرماتوژنز نقش ایفا میکنند، دارای گیرندههای مختلفی در اکثر بافتهای بدن مانند بیضه بوده و جهت حفظ و توسعه سلولهای بنیادی دارای اهمیت هستند [28]. چن و همکاران در مطالعه خود اذعان داشتند که بیماری آزواسپرمی منجر به کاهش سطح رشد و توسعه و حتی تکثیر و تمایز سلولهای بنیادی میشود و کاهش سطح کیفیت اسپرمزایی منجر به پایین آمدن سطح بیان ژن PLZF و TNP میشود [18]. کاهش سطح گیرندههای SSCs، مانع از تولید و بیان سلولهای بنیادی اسپرماتوگونی میشود [29]. بنابراین به نظر میرسد کاهش گیرندهها و افزایش التهاب در بیماران آزواسپرمی، میتواند منجر به کاهش سطح بیان ژن PLZF و TNPشود [28].
همچنین نتایج تحقیق حاضر نشان داد که هشت هفته تمرین شنا با شدت پایین سبب افزایش غیرمعنادار بیان ژن PLZF و TNP موشهای صحرایی گروه تمرینی شنا در مقایسه با گروه آزواسپرمی شد. از آنجایی که مکانسیم روشنی از تأثیرگذاری فعالیت بدنی بر بیان ژن PLZF و TNPهنوز بهدرستی مشخص نشده است، ممکن است توضیح نتایج تحقیقات بهدرستی امکانپذیر نباشد. نتایج برخی از مطالعات همراستا با نتایج تحقیق حاضر، اثر افزایشی ورزش هوازی بر بیان ژن سلولهای بنیادی اسپرماتوگونی را ثابت کردند [21، 22، 23، 24].
فرنس و همکاران در مطالعه خود اینگونه اذعان داشتند که شدت فعالیت هوازی بهویژه انجام فعالیت هوازی با شدت متوسط، قابلیت اثرگذاری و تعدیل و بهبود نشانگرهای اسپرماتوژنز مانند PLZF و TNP را دارد و کاهش سطح التهاب در بیماران نارور را در پی دارد [22]. در راستای نتایج این تحقیق، نشان داده شد که تمرین هوازی با توجه به بهبود کاهش سطح بیان ژنهای التهابی و بهبود سلولهای بنیادی اسپرماتوگونی، سطح کیفیت جنسی و باروری را افزایش میدهد [23].
فعالیت بدنی میتواند باعث آزاد شدن اکسید نیتریک شود. اکسید نیتریک، آنزیم گوانیل سیکلاز را فعال کرده و در نتیجه میزان cGMP افزایش مییابد. این افزایش منجر به اتساع عروق دستگاه تناسلی شده و باعث افزایش جریان خون در آن میشود و متعاقب آن منجر به افزایش تولید اسپرم میشود [30]. این تغییرات باعث کاهش احتمال ناباروری در افرادی میشود که به علت کمبود اسپرم دچار عقیمی شدهاند [31]؛ به عبارت دیگر، فعالیت بدنی از طریق اتساع عروق و افزایش چرخه جریان خون در اندامهای بدن از قبیل دستگاه تناسلی منجر به افزایش اسپرمزایی و درمان ناباروری ناشی از اسپرماتوژنز میشود [32]. همینطور افزایش چگالی مویرگی در پاسخ به فعالیتهای ورزشی منجر به فراهم کردن اکسیژن کافی در بافتها میشود و این مورد باعث فعالسازی و تغییر در نفوذپذیری غشای سلولی و به دنبال آن افزایش ساختهشدن mRNA و تقسیم سلولی میشود و سطح بیان ژن سلولهای بنیادی اسپرماتوگونی افزایش مییابد [33].
جوزکو و همکاران در مطالعه خود اذعان داشتند که افزایش چگالی مویرگی و جریان خون، منجر به بهبود سطح و تحرک سلولهای بنیادی و تمایز سلولهای بارور میشود [23]. همچنین تحقیقات انجامشده روی اثرگذاری فعالیت بدنی بر سلولهای بنیادی اسپرماتوگونی نشان میدهد که به دنبال فعالیت بدنی بهویژه هوازی، پاسخ سلولی با فعال شدن فوتواکسپتورهای موجود در زنجیره تنفسی واقع در میتوکندری آغاز شده و در اثر آن ردوکس سلولی تغییر حالت میدهد و همراه با تغییرات حالت غشای سلولی با جابهجایی کلسیم و تغییرات PH و فعال شدنCAMP و مضاعف شدن DNA منجر به ساخته شدن پروتئینهای جدید و تکثیر سلولی میشود [34]. به این ترتیب پاسخهای سلولی از سطح سلولی به سطح بافت و ارگان کشانده میشود و اثراتی مانند تکثیر سلولی، نئوواسکولاریزاسیون، شیفت متابولیسم به سمت هوازی و متعادل کردن سطح باروری و کاهش ناباروری حاصل میشود [35، 36].
نتیجهگیری
به طور کلی نتایج تحقیق حاضر بیانگر آن است که تغییر مولکولهای کلیدی یا مسیرهای سیگنالی و بیان ژن PLZF و TNP در فرایند اسپرماتوژنز میتواند باعث کاهش باروری و افزایش ناباروری شود، ولی فعالیت ورزشی منظم هوازی مانند شنا با شدت پایین در مهار آثار ناشی از بیماریهای ناباروری از طریق افزایش حفظ و توسعه سلولها بنیادی اسپرماتوگونی کمک شایانی میکند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
پژوهشگران کلیه قوانین اخلاقی مرتبط با تحقیقات روی حیوانات را رعایت کردند. این مطالعه با کد اخلاق IR.IAU.SARI.REC.1398.149 به ثبت رسیده است.
حامی مالی
هزینه مالی این مطالعه به صورت شخصی تأمین شده است. این مقاله برگرفته از رساله دوره دکتری پروین فرزانگی در گروه فیزیولوژی ورزشی، واحد ساری، دانشگاه آزاد اسلامی، ساری، است.
مشارکت نویسندگان
جمعآوری دادهها: لیلا ظهرابی کورانی؛ ارائه ایده تحقیق، طراحی مطالعه، نگارش و ویرایش نسخه خطی: پروین فرزنگی؛ تجزیه و تحلیل دادهها و بررسی اولیه: محمدعلی آذربایجانی.
تعارض منافع
هیچگونه تعارض منافعی توسط نویسندگان بیان نشده است.
در تحقیق حاضرتأثیر هشت هفته تمرین شنا با شدت پایین بر بیان ژن PLZF و TNP در موشهای مدل آزواسپرمی مورد بررسی قرار گرفت. از نتایج مهم تحقیق حاضر کاهش معنادار سطح بیان ژن PLZF و TNP موشهای صحرایی مدل آزواسپرمی نسبت به گروه سالم است. نتایج مطالعه حاضر با نتایج مطالعه برخی از محقین که در تحقیق خود اظهار داشتند بیماری آزواسپرمی منجر به تغییر بیان ژنهای درگیر در باروری از قبیل PLZF و TNPمیشود، همسوست [22، 23، 24]. PLZF و TNP از مارکرهای اساسی در حفظ و توسعه سلولهای بنیادی اسپرماتوگونی شناخته شدند [27].
نتایج تحقیقات نشان داد که درمردان نابارور اسپرماتوزوها تغییرات هستهای زیادی شامل ساختار غیرطبیعی کروماتین و شکستهای رشتهای DNA وجود دارد که منجر به تغییر در سطح بیان این ژن میشود [13]. این ژنها که در تکثیر و تمایز سلولهای بنیادی اسپرماتوژنز نقش ایفا میکنند، دارای گیرندههای مختلفی در اکثر بافتهای بدن مانند بیضه بوده و جهت حفظ و توسعه سلولهای بنیادی دارای اهمیت هستند [28]. چن و همکاران در مطالعه خود اذعان داشتند که بیماری آزواسپرمی منجر به کاهش سطح رشد و توسعه و حتی تکثیر و تمایز سلولهای بنیادی میشود و کاهش سطح کیفیت اسپرمزایی منجر به پایین آمدن سطح بیان ژن PLZF و TNP میشود [18]. کاهش سطح گیرندههای SSCs، مانع از تولید و بیان سلولهای بنیادی اسپرماتوگونی میشود [29]. بنابراین به نظر میرسد کاهش گیرندهها و افزایش التهاب در بیماران آزواسپرمی، میتواند منجر به کاهش سطح بیان ژن PLZF و TNPشود [28].
همچنین نتایج تحقیق حاضر نشان داد که هشت هفته تمرین شنا با شدت پایین سبب افزایش غیرمعنادار بیان ژن PLZF و TNP موشهای صحرایی گروه تمرینی شنا در مقایسه با گروه آزواسپرمی شد. از آنجایی که مکانسیم روشنی از تأثیرگذاری فعالیت بدنی بر بیان ژن PLZF و TNPهنوز بهدرستی مشخص نشده است، ممکن است توضیح نتایج تحقیقات بهدرستی امکانپذیر نباشد. نتایج برخی از مطالعات همراستا با نتایج تحقیق حاضر، اثر افزایشی ورزش هوازی بر بیان ژن سلولهای بنیادی اسپرماتوگونی را ثابت کردند [21، 22، 23، 24].
فرنس و همکاران در مطالعه خود اینگونه اذعان داشتند که شدت فعالیت هوازی بهویژه انجام فعالیت هوازی با شدت متوسط، قابلیت اثرگذاری و تعدیل و بهبود نشانگرهای اسپرماتوژنز مانند PLZF و TNP را دارد و کاهش سطح التهاب در بیماران نارور را در پی دارد [22]. در راستای نتایج این تحقیق، نشان داده شد که تمرین هوازی با توجه به بهبود کاهش سطح بیان ژنهای التهابی و بهبود سلولهای بنیادی اسپرماتوگونی، سطح کیفیت جنسی و باروری را افزایش میدهد [23].
فعالیت بدنی میتواند باعث آزاد شدن اکسید نیتریک شود. اکسید نیتریک، آنزیم گوانیل سیکلاز را فعال کرده و در نتیجه میزان cGMP افزایش مییابد. این افزایش منجر به اتساع عروق دستگاه تناسلی شده و باعث افزایش جریان خون در آن میشود و متعاقب آن منجر به افزایش تولید اسپرم میشود [30]. این تغییرات باعث کاهش احتمال ناباروری در افرادی میشود که به علت کمبود اسپرم دچار عقیمی شدهاند [31]؛ به عبارت دیگر، فعالیت بدنی از طریق اتساع عروق و افزایش چرخه جریان خون در اندامهای بدن از قبیل دستگاه تناسلی منجر به افزایش اسپرمزایی و درمان ناباروری ناشی از اسپرماتوژنز میشود [32]. همینطور افزایش چگالی مویرگی در پاسخ به فعالیتهای ورزشی منجر به فراهم کردن اکسیژن کافی در بافتها میشود و این مورد باعث فعالسازی و تغییر در نفوذپذیری غشای سلولی و به دنبال آن افزایش ساختهشدن mRNA و تقسیم سلولی میشود و سطح بیان ژن سلولهای بنیادی اسپرماتوگونی افزایش مییابد [33].
جوزکو و همکاران در مطالعه خود اذعان داشتند که افزایش چگالی مویرگی و جریان خون، منجر به بهبود سطح و تحرک سلولهای بنیادی و تمایز سلولهای بارور میشود [23]. همچنین تحقیقات انجامشده روی اثرگذاری فعالیت بدنی بر سلولهای بنیادی اسپرماتوگونی نشان میدهد که به دنبال فعالیت بدنی بهویژه هوازی، پاسخ سلولی با فعال شدن فوتواکسپتورهای موجود در زنجیره تنفسی واقع در میتوکندری آغاز شده و در اثر آن ردوکس سلولی تغییر حالت میدهد و همراه با تغییرات حالت غشای سلولی با جابهجایی کلسیم و تغییرات PH و فعال شدنCAMP و مضاعف شدن DNA منجر به ساخته شدن پروتئینهای جدید و تکثیر سلولی میشود [34]. به این ترتیب پاسخهای سلولی از سطح سلولی به سطح بافت و ارگان کشانده میشود و اثراتی مانند تکثیر سلولی، نئوواسکولاریزاسیون، شیفت متابولیسم به سمت هوازی و متعادل کردن سطح باروری و کاهش ناباروری حاصل میشود [35، 36].
نتیجهگیری
به طور کلی نتایج تحقیق حاضر بیانگر آن است که تغییر مولکولهای کلیدی یا مسیرهای سیگنالی و بیان ژن PLZF و TNP در فرایند اسپرماتوژنز میتواند باعث کاهش باروری و افزایش ناباروری شود، ولی فعالیت ورزشی منظم هوازی مانند شنا با شدت پایین در مهار آثار ناشی از بیماریهای ناباروری از طریق افزایش حفظ و توسعه سلولها بنیادی اسپرماتوگونی کمک شایانی میکند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
پژوهشگران کلیه قوانین اخلاقی مرتبط با تحقیقات روی حیوانات را رعایت کردند. این مطالعه با کد اخلاق IR.IAU.SARI.REC.1398.149 به ثبت رسیده است.
حامی مالی
هزینه مالی این مطالعه به صورت شخصی تأمین شده است. این مقاله برگرفته از رساله دوره دکتری پروین فرزانگی در گروه فیزیولوژی ورزشی، واحد ساری، دانشگاه آزاد اسلامی، ساری، است.
مشارکت نویسندگان
جمعآوری دادهها: لیلا ظهرابی کورانی؛ ارائه ایده تحقیق، طراحی مطالعه، نگارش و ویرایش نسخه خطی: پروین فرزنگی؛ تجزیه و تحلیل دادهها و بررسی اولیه: محمدعلی آذربایجانی.
تعارض منافع
هیچگونه تعارض منافعی توسط نویسندگان بیان نشده است.
References
1.Ernst C, Eling N, Martinez-Jimenez CP, Marioni JC, Odom DT. Staged developmental mapping and X chromosome transcriptional dynamics during mouse spermatogenesis. Nature Communications. 2019; 10(1):1251. [DOI:10.1038/s41467-019-09182-1] [PMID] [PMCID]
2.Ni FD, Hao SL, Yang WX. Multiple signaling pathways in Sertoli cells: Recent Findings in spermatogenesis. Cell Death & Disease. 2019; 10(8):541. [DOI:10.1038/s41419-019-1782-z] [PMID] [PMCID]
3.Griswold MD. Spermatogenesis: The commitment to meiosis. Physiological Reviews. 2016; 96(1):1-17. [DOI:10.1152/physrev.00013.2015] [PMID] [PMCID]
4.Gutierrez K, Glanzner WG, Chemeris RO, Rigo ML, Comim FV, Bordignon V, et al. Gonadotoxic effects of busulfan in two strains of mice. Reproductive Toxicology. 2016; 59:31-9. [DOI:10.1016/j.reprotox.2015.09.002] [PMID]
5.Khanehzad M, Abolhasani F, Koruji SM, Ragerdi Kashani I, Aliakbari F. [The roles of Sertoli cells in fate determinations of spermatogonial stem cells (Persian)]. Tehran University Medical Journal. 2016; 73(12):878-87. http://tumj.tums.ac.ir/article-1-7253-en.html
6.Cioppi F, Casamonti E, Krausz C. Age-dependent de novo mutations during spermatogenesis and their consequences. Advances in Experimental Medicine and Biology. 2019; 1166:29-46. [DOI:10.1007/978-3-030-21664-1_2] [PMID]
7.Fahnenstich J, Nandy A, Milde-Langosch K, Schneider-Merck T, Walther N, Gellersen B. Promyelocytic Leukaemia Zinc Finger protein (PLZF) is a glucocorticoid- and progesterone-induced transcription factor in human endometrial stromal cells and myometrial smooth muscle cells. Molecular Human Reproduction. 2003; 9(10):611-23. [DOI:10.1093/molehr/gag080] [PMID]
8.Wang X, Wang J, Zhang L. Characterization of atypical acute promyelocytic leukaemia: Three cases report and literature review. Medicine (Baltimore). 2019; 98(19):e15537. [DOI:10.1097/MD.0000000000015537] [PMID] [PMCID]
9.Fayomi AP, Orwig KE. Spermatogonial stem cells and spermatogenesis in mice, monkeys and men. Stem Cell Research. 2018; 29:207-14. [DOI:10.1016/j.scr.2018.04.009] [PMID] [PMCID]
10.Savage AK, Constantinides MG, Han J, Picard D, Martin E, Li B, et al. The transcription factor PLZF directs the effector program of the NKT cell lineage. Immunity. 2008; 29(3):391-403. [DOI:10.1016/j.immuni.2008.07.011] [PMID] [PMCID]
11.Jin Y, Nenseth HZ, Saatcioglu F. Role of PLZF as a tumor suppressor in prostate cancer. Oncotarget. 2017; 8(41):71317-24. [DOI:10.18632/oncotarget.19813] [PMID] [PMCID]
12.Liu TM, Lee EH, Lim B, Shyh-Chang N. Concise review: Balancing stem cell self-renewal and differentiation with PLZF. Stem Cells. 2016; 34(2):277-87. [DOI:10.1002/stem.2270] [PMID]
13.Meistrich ML, Mohapatra B, Shirley CR, Zhao M. Roles of transition nuclear proteins in spermiogenesis. Chromosoma. 2003; 111(8):483-8. [DOI:10.1007/s00412-002-0227-z] [PMID]
14.Jedrzejczak P, Kempisty B, Bryja A, Mostowska M, Depa-Martynow M, Pawelczyk L, et al. Quantitative assessment of transition proteins 1, 2 spermatid-specific linker histone H1-like protein transcripts in spermatozoa from normozoospermic and asthenozoospermic men. Archives of Andrology. 2007; 53(4):199-205. [DOI:10.1080/01485010701426430] [PMID]
15.Meistrich ML. Effects of chemotherapy and radiotherapy on spermatogenesis in humans. Fertility and Sterility. 2013; 100(5):1180-6. [DOI:10.1016/j.fertnstert.2013.08.010] [PMID] [PMCID]
16.Torma F, Koltai E, Nagy E, Mosaferi Ziaaldini M, Posa A, Koch LG, et al. Exercise increases markers of spermatogenesis in rats selectively bred for low running capacity. PLoS One. 2014; 9(12):e114075. [DOI:10.1371/journal.pone.0114075] [PMID] [PMCID]
17.Mohaqiq M, Movahedin M, Mazaheri Z, Amirjannati N. Successful human spermatogonial stem cells homing in recipient mouse testis after in vitro transplantation and organ culture. Cell Journal. 2019; 20(4):513-20. [DOI:10.26226/morressier.5af300b3738ab10027aa9b14] [PMID] [PMCID]
18.Chen H, Tang QL, Wu XY, Xie LC, Lin LM, Ho GY, et al. Differentiation of human umbilical cord mesenchymal stem cells into germ-like cells in mouse seminiferous tubules. Molecular Medicine Reports. 2015; 12(1):819-28. [DOI:10.3892/mmr.2015.3528] [PMID] [PMCID]
19.Bagheri Hamzian Olya J, Khadem Ansari MH, Yaghmaei P. [The effect of endurance running activities on Prolactin, Testosterone and DHEA-S levels (Persian)]. The Journal of Urmia University of Medical Sciences. 2011; 21(5):391-7. http://umj.umsu.ac.ir/article-1-828-en.html
20.Taher Z, Hamednia M, Haghighi H. [Investigation of effect of one session moderate and heavy resistance exercise on acute and delayed responses of leptin, insulin, cortisol, testosterone and 24- hour energy expenditure in healthy men (Persian)]. Iranian Journal of Endocrinology & Metabolism. 2011; 13(1):67-73. http://ijem.sbmu.ac.ir/article-1-871-fa.html
21.Urhausen A, Kullmer T, Kindermann W. A 7-week follow up study of the behavior of testosterone and cortisol during the competition period in rowers. European Journal of Applied Physiology and Occupational Physiology. 1987; 56(5):528-33. [DOI:10.1007/BF00635365] [PMID]
22.Manna I, Jana K, Samanta PK. Effect of intensive exercise-induced testicular gametogenic and steroidogenic disorders in mature male Wistar strain rats: A correlative approach to oxidative stress. Acta Physiologica Scandinavica. 2003; 178(1):33-40. [DOI:10.1046/j.1365-201X.2003.01095.x] [PMID]
23.Vaamonde D, Garcia-Manso JM, Hackney AC. Impact of physical activity and exercise on male reproductive potential: A new assessment questionnaire. Revista Andaluza de Medicina del Deporte. 2017; 10(2):79-93. [DOI:10.1016/j.ramd.2016.11.017] [PMID] [PMCID]
24.Jóźków P, Rossato M. The impact of intense exercise on semen quality. American Journal of Men’s Health. 2017; 11(3):654-62. [DOI:10.1177/1557988316669045] [PMID] [PMCID]
25.National Research Council, Division on Earth and Life Studies, Institute for Laboratory Animal Research, Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide to the care and use of experimental animals. 2nd ed. Ottawa: Canadian Council on Animal Care Ottawa Pub; 1993. https://www.ncbi.nlm.nih.gov/books/NBK54050/
26.Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Research. 2001; 29(9):e45. [DOI:10.1093/nar/29.9.e45] [PMID] [PMCID]
27.Costoya JA, Hobbs RM, Barna M, Cattoretti G, Manova K, Sukhwani M, et al. Essential role of Plzf in maintenance of spermatogonial stem cells. Nature Genetics. 2004; 36(6):653-9. [DOI:10.1038/ng1367] [PMID]
28.Choi WI, Kim MY, Jeon BN, Koh DI, Yun CO, Li Y, et al. Role of Promyelocytic Leukemia Zinc Finger (PLZF) in cell proliferation and cyclin-dependent kinase inhibitor 1A (p21WAF/CDKN1A) gene repression. The Journal of Biological Chemistry. 2014; 289(27):18625-40. [DOI:10.1074/jbc.M113.538751] [PMID] [PMCID]
29.Hsu YH, Chen YC, Chen TH, Sue YM, Cheng TH, Chen JR, et al. Far-infrared therapy induces the nuclear translocation of PLZF which inhibits VEGF-induced proliferation in human umbilical vein endothelial cells. PLoS One. 2012; 7(1):e30674. [DOI:10.1371/journal.pone.0030674] [PMID] [PMCID]
30.Kemi OJ, Wislff U. Mechanisms of exercise-induced improvements in the contractile apparatus of the mammalian myocardium. Acta Physiologica (Oxf). 2010; 199(4):425-39. [DOI:10.1111/j.1748-1716.2010.02132.x] [PMID]
31.Farup J, Sørensen H, Kjølhede T. Similar changes in muscle fiber phenotype with differentiated consequences for rate of force development: Endurance versus resistance training. Human Movement Science. 2014; 34:109-19. [DOI:10.1016/j.humov.2014.01.005] [PMID]
32.Snijders T, Nederveen JP, Joanisse S, Leenders M, Verdijk LB, van Loon LJC, et al. Muscle fibre capillarization is a critical factor in muscle fibre hypertrophy during resistance exercise training in older men. Journal of Cachexia, Sarcopenia and Muscle. 2017; 8(2):267-76. [DOI:10.1002/jcsm.12137] [PMID] [PMCID]
33.Kingsley JD, Figueroa A. Acute and training effects of resistance exercise on heart rate variability. Clinical Physiology and Functional Imaging. 2016; 36(3):179-87. [DOI:10.1111/cpf.12223] [PMID]
34.Isner-Horobeti ME, Dufour SP, Vautravers P, Geny B, Coudeyre E, Richard R. Eccentric exercise training: Modalities, applications and perspectives. Sports Medicine. 2013; 43(6):483-512. [DOI:10.1007/s40279-013-0052-y] [PMID]
35.Shulman GI, Rothman DL, Jue T, Stein P, DeFronzo RA, Shulman RG. Quantitation of muscle glycogen synthesis in normal subjects and subjects with non-insulin-dependent diabetes by 13C nuclear magnetic resonance spectroscopy. The New England Journal of Medicine. 1990; 322(4):223-8. [DOI:10.1056/NEJM199001253220403] [PMID]
36.Pozefsky T, Tancredi RG, Moxley RT, Dupre J, Tobin JD. Effects of brief starvation on muscle amino acid metabolism in nonobese man. The Journal of Clinical Investigation. 1976; 57(2):444-9. [DOI:10.1172/JCI108295] [PMID] [PMCID]
نوع مطالعه: پژوهشی |
موضوع مقاله:
فيزيولوژی پزشکی
دریافت: 1398/8/25 | پذیرش: 1398/10/16 | انتشار: 1399/7/10
دریافت: 1398/8/25 | پذیرش: 1398/10/16 | انتشار: 1399/7/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






.jpg)