

دوره 28، شماره 3 - ( تابستان 1401 )
جلد 28 شماره 3 صفحات 381-366 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Amirsardari B, Saremi A, Malekipouya M. The Effect of an Incremental Training Rehabilitation Period on the Serum Levels of Pentraxin-3 and Osteoprotegerin in Rats With Myocardial Infarction. Intern Med Today 2022; 28 (3) :366-381
URL: http://imtj.gmu.ac.ir/article-1-3871-fa.html
URL: http://imtj.gmu.ac.ir/article-1-3871-fa.html
امیرسرداری بابک، صارمی عباس، ملکیپویا محمد. تأثیر یک دوره بازتوانی ورزشی فزآینده بر سطوح سرمی پنتراکسین-3 و استئوپروتگرین موشهای صحرایی با سکته قلبی. طب داخلی روز. 1401; 28 (3) :366-381
بابک امیرسرداری1 

 ، عباس صارمی2
، عباس صارمی2 

 ، محمد ملکیپویا*3
، محمد ملکیپویا*3 




 ، عباس صارمی2
، عباس صارمی2 

 ، محمد ملکیپویا*3
، محمد ملکیپویا*3 


1- گروه تربیت بدنی، دانشکده علوم ورزشی، واحد بروجرد، دانشگاه آزاد اسلامی، بروجرد، ایران.
2- گروه فیزیولوژی ورزش، دانشکده علوم ورزشی، دانشگاه اراک، اراک، ایران.
3- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، واحد پورفسور حسابی تفرش، دانشگاه آزاد اسلامی، تفرش، ایران. ،malekipooya@iautb.ac.ir
2- گروه فیزیولوژی ورزش، دانشکده علوم ورزشی، دانشگاه اراک، اراک، ایران.
3- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، واحد پورفسور حسابی تفرش، دانشگاه آزاد اسلامی، تفرش، ایران. ،
متن کامل [PDF 4772 kb]
(1192 دریافت)
| چکیده (HTML) (3253 مشاهده)
References
1.Virani SS, Alonso A, Benjamin EJ, Bittencourt MS, Callaway CW, Carson AP, et al. Heart disease and stroke statistics-2020 update: A report from the American Heart Association. Circulation. 2020; 141(9):e139-596. [DOI:10.1161/CIR.0000000000000757] [PMCID]
2.Zhao ZQ. Velez DA, Wang NP, Hewan-Lowe KO, Nakamura M, Guyton RA, et al. Progressively developed myocardial apoptotic cell death during late phase of reperfusion. Apoptosis. 2001; 6(4):279-90. [DOI:10.1023/A:1011335525219] [PMID]
3.Krishnamurthy P, Rajasingh J, Lambers E, Qin G, Losordo DW, Kishore R. IL-10 inhibits inflammation and attenuates left ventricular remodeling after myocardial infarction via activation of STAT3 and suppression of HuR. Circulation Research. 2009; 104(2):e9-18. [DOI:10.1161/CIRCRESAHA.108.188243] [PMID] [PMCID]
4.Joshi NV, Toor I, Shah AS, Carruthers K, Vesey AT, Alam SR, et al. Systemic atherosclerotic inflammation following acute myocardial infarction: Myocardial infarction begets myocardial infarction. Journal of the American Heart Association. 2015; 4(9):e001956. [DOI:10.1161/JAHA.115.001956] [PMID] [PMCID]
5.Rolph MS, Zimmer S, Bottazzi B, Garlanda C, Mantovani A, Hansson GK. Production of the long pentraxin PTX3 in advanced atherosclerotic plaques. Arteriosclerosis, Thrombosis, and Vascular Biology. 2002; 22(5):e10-4. [DOI:10.1161/01.ATV.0000015595.95497.2F] [PMID]
6.Yang HS, Woo JE, Lee SJ, Park SH, Woo JM. Elevated plasma pentraxin 3 levels are associated with development and progression of diabetic retinopathy in Korean patients with type 2 diabetes mellitus. Investigative Ophthalmology & Visual Science. 2014; 55(9):5989-97.[DOI:10.1167/iovs.14-14864] [PMID]
7.Miyaki A, Maeda S, Choi Y, Akazawa N, Tanabe Y, Ajisaka R. Habitual aerobic exercise increases plasma pentraxin 3 levels in middle-aged and elderly women. Applied Physiology, Nutrition, and Metabolism. 2012; 37(5):907-11. [DOI:10.1139/h2012-069] [PMID]
8.Collin-Osdoby P. Regulation of vascular calcification by osteoclast regulatory factors RANKL and osteoprotegerin. Circulation Research. 2004; 95(11):1046-57. [DOI:10.1161/01.RES.0000149165.99974.12] [PMID]
9.Caidahl K, Ueland T, Aukrust P. Osteoprotegerin: A biomarker with many faces. Arteriosclerosis, Thrombosis, and Vascular Biology. 2010; 30(9):1684-6. [DOI:10.1161/ATVBAHA.110.208843] [PMID]
10.Kruzliak P, Berezin A, Kremzer A, Samura T, Benacka R, Mozos I, et al. Global longitudinal strain and strain rate in type two diabetes patients with chronic heart failure: Relevance to osteoprotegerin. Folia Medica. 2016; 58(3):164-73. [DOI:10.1515/folmed-2016-0021] [PMID]
11.Lawler PR, Filion KB, Eisenberg MJ. Efficacy of exercise-based cardiac rehabilitation post–myocardial infarction: A systematic review and meta-analysis of randomized controlled trials. American Heart Journal. 2011; 162(4):571-84. [DOI:10.1016/j.ahj.2011.07.017] [PMID]
12.Fukuda T, Kurano M, Iida H, Takano H, Tanaka T, Yamamoto Y, et al. Cardiac rehabilitation decreases plasma pentraxin 3 in patients with cardiovascular diseases. European Journal of Preventive Cardiology. 2012; 19(6):1393-400. [DOI:10.1177/1741826711422990] [PMID]
13.Basati F, Siahkoohian M, Golabchi A, Moshtaghi M. [Effects of 8 weeks aerobic exercise training on plasma levels of pentraxin3 and C-reactive protein in diabetic and non-diabetic coronary artery disease patients after revascularization interventions (Persian)]. Sport Physiology. 2018; 10(38):163-80. [doi:10.22089/spj.2018.4161.1562]
14.Sponder M, Campean IA, Emich M, Fritzer-Szekeres M, Litschauer B, Bergler-Klein J, et al. Endurance training significantly increases serum endocan but not osteoprotegerin levels: a prospective observational study. BMC Cardiovascular Disorders. 2017; 17(1):13.[DOI:10.1186/s12872-016-0452-7] [PMID] [PMCID]
15.Kim JY, Kim HJ, Kim CS. Effects of 12-week combined exercise on RANKL/RANK/OPG signaling and bone-resorption cytokines in healthy college females. Journal of Exercise Nutrition & Biochemistry. 2019; 23(1):13-20. [DOI:10.20463/jenb.2019.0003] [PMID] [PMCID]
16.Bertinchant JP, Robert E, Polge A, Marty-Double C, Fabbro-Peray P, Poirey S, et al. Comparison of the diagnostic value of cardiac troponin I and T determinations for detecting early myocardial damage and the relationship with histological findings after isoprenaline-induced cardiac injury in rats. Clinica Chimica Acta. 2000; 298(1-2):13-28.[DOI:10.1016/S0009-8981(00)00223-0] [PMID]
17.Lobo Filho HG, Ferreira NL, Sousa RB, Carvalho ER, Lobo PL, Lobo Filho JG. Modelo experimental de infarto do miocárdio induzido por isoproterenol em ratos. Brazilian Journal of Cardiovascular Surgery. 2011; 26(3):469-76. [DOI:10.5935/1678-9741.20110024] [PMID]
18.MalekiPoya M, Palizvan MR, Saremi A. [The effect of eight weeks of incremental endurance training on the levels of matrix metalloproteinase-1 (MMP1) and thrombosponidine-1 (TSP1) in the rats, induced by myocardial infarction by isoproterenol (Persian)]. Journal of Arak University of Medical Sciences. 2019; 22(3):118-28. [Link]
19.Afzalpoura ME, Yousefib MR, Eivaric SH, Ilbeigid S. Changes in blood insulin resistance, GLUT4 & AMPK after continuous and interval aerobic training in normal and diabetic rats. Journal of Applied Pharmaceutical Science. 2016; 6(9):076-81. [DOI:10.7324/JAPS.2016.60911]
20.Prabhu SD, Frangogiannis NG. The biological basis for cardiac repair after myocardial infarction: From inflammation to fibrosis. Circulation Research. 2016; 119(1):91-112. [DOI:10.1161/CIRCRESAHA.116.303577] [PMID] [PMCID]
21.Newby LK. Inflammation as a treatment target after acute myocardial infarction. The New England Journal of Medicine. 2019; 381(26):2562-3. [DOI:10.1056/NEJMe1914378] [PMID]
22.Pokorný J, Staněk V, Vrána M. Sudden cardiac death thirty years ago and at present. The role of autonomic disturbances in acute myocardial infarction revisited. Physiological Research. 2011; 60(5):715-28. [DOI:10.33549/physiolres.932110] [PMID]
23.López-Mejías R, Castañeda S, González-Juanatey C, Corrales A, Ferraz-Amaro I, Genre F, et al. Cardiovascular risk assessment in patients with rheumatoid arthritis: The relevance of clinical, genetic and serological markers. Autoimmunity Reviews. 2016; 15(11):1013-30. [DOI:10.1016/j.autrev.2016.07.026] [PMID]
24.Ruberti OM, Sousa AS, Viana LR, Pereira Gomes MF, Medeiros A, Gomes Marcondes MC, et al. Aerobic training prevents cardiometabolic changes triggered by myocardial infarction in ovariectomized rats. Journal of Cellular Physiology. 2021; 236(2):1105-15. [DOI:10.1002/jcp.29919] [PMID]
25.Upaganlawar A, Gandhi C, Balaraman R. Effect of green tea and vitamin E combination in isoproterenol induced myocardial infarction in rats. Plant Foods for Human Nutrition. 2009; 64(1):75-80. [DOI:10.1007/s11130-008-0105-9] [PMID]
26.Amirsardari B, Saremi A, Maleki Pouya M. [Early exercise training attenuates cystatin C and carbohydrate antigen 125 levels after myocardial infarction in rats (Persian)]. Journal of Cell and Tissue. 2021; 12(1). [DOI:10.52547/JCT.12.1.1]
27.Ranjbar K, Nazem F, Nazari A, Golami Mr. [Effect of 10 weeks aerobic exercise training on left ventricular systolic function, Caspase-3 level and infarction size in myocardial infarction rat (Persian)]. Journal of Knowledge & Health. 2015; 10(3):16-24. [Link]
28.Azamian jazi A, Haffezi MR, Cheraghi J, Abdi H. [The combined effect of endurance training and atorvastatin on the extent of necrosis damageand fibrosis tissue in male wistar rats heart after experimental myocardial infarction (Persian)]. Journal of Ilam University of Medical Sciences. 2016; 23(7):28-38. [Link]
29.Tunc-Ata M, Turgut G, Mergen-Dalyanoglu M, Turgut S. Examination of levels pentraxin-3, interleukin-6, and C-reactive protein in rat model acute and chronic exercise. Journal of Exercise Rehabilitation. 2017; 13(3):279-83. [DOI:10.12965/jer.1734920.490] [PMID] [PMCID]
30.Nakajima T, Kurano M, Hasegawa T, Takano H, Iida H, Yasuda T, et al. Pentraxin3 and high-sensitive C-reactive protein are independent inflammatory markers released during high-intensity exercise. European Journal of Applied Physiology. 2010; 110(5):905-13. [DOI:10.1007/s00421-010-1572-x] [PMID]
31.Bottazzi B, Inforzato A, Messa M, Barbagallo M, Magrini E, Garlanda C, et al. The pentraxins PTX3 and SAP in innate immunity, regulation of inflammation and tissue remodelling. Journal of Hepatology. 2016; 64(6):1416-27.[DOI:10.1016/j.jhep.2016.02.029] [PMID] [PMCID]
32.Shiraki A, Kotooka N, Komoda H, Hirase T, Oyama JI, Node K. Pentraxin-3 regulates the inflammatory activity of macrophages. Biochemistry and Biophysics Reports. 2016; 5:290-5. [DOI:10.1016/j.bbrep.2016.01.009] [PMID] [PMCID]
33.Fornai F, Carrizzo A, Forte M, Ambrosio M, Damato A, Ferrucci M, et al. The inflammatory protein Pentraxin 3 in cardiovascular disease. Immunity & Ageing. 2016; 13(1):25. [DOI:10.1186/s12979-016-0080-1] [PMID] [PMCID]
34.Zempo-Miyaki A, Fujie S, Sato K, Hasegawa N, Sanada K, Maeda S, et al. Elevated pentraxin 3 level at the early stage of exercise training is associated with reduction of arterial stiffness in middle-aged and older adults. Journal of Human Hypertension. 2016; 30(9):521-6. [DOI:10.1038/jhh.2015.105] [PMID]
35.Davenport C, Kenny H, Ashley DT, O’Sullivan EP, Smith D, O’Gorman DJ. The effect of exercise on osteoprotegerin and TNF-related apoptosis-inducing ligand in obese patients. European journal of Clinical Investigation. 2012; 42(11):1173-9. [DOI:10.1111/j.1365-2362.2012.02703.x] [PMID]
36.Gaeini A, Eslaminejad MB, Choobineh S, Mousavi N, Satarifard S, Shafieineek L. Effects of exercise prior or during pregnancy in high fat diet fed mice alter bone gene expression of female offspring: An experimental study. International Journal of Reproductive BioMedicine. 2017; 15(2):93-100. [PMID]
37.Farzanegi P, Niak KE, Habibian M. [The effect of circuit resistance training with Medicago sativa extracts on levels of osteoprotegerin and nuclear factor of Kappa-B in thin girls (Persian)]. Pars Journal of Medical Sciences. 2016; 14(3):27-34. [DOI:10.29252/jmj.14.3.27]
38.Fuernau G, Poenisch C, Eitel I, de Waha S, Desch S, Schuler G, et al. Growth-differentiation factor 15 and osteoprotegerin in acute myocardial infarction complicated by cardiogenic shock: A biomarker substudy of the IABP-SHOCK II-trial. European Journal of Heart Failure. 2014; 16(8):880-7. [DOI:10.1002/ejhf.117] [PMID]
39.Bernardi S, Bossi F, Toffoli B, Fabris B. Roles and clinical applications of OPG and TRAIL as biomarkers in cardiovascular disease. BioMed Research International. 2016; 2016:1752854. [DOI:10.1155/2016/1752854] [PMID] [PMCID]
40.Sandberg WJ, Yndestad A, Øie E, Smith C, Ueland T, Ovchinnikova O, et al. Enhanced T-cell expression of RANK ligand in acute coronary syndrome: Possible role in plaque destabilization. Arteriosclerosis, Thrombosis, and vascular Biology. 2006; 26(4):857-63. [DOI:10.1161/01.ATV.0000204334.48195.6a][PMID] [PMID]
41.Calegari L, Nunes RB, Mozzaquattro BB, Rossato DD, Dal Lago P. Exercise training improves the IL-10/TNF-α cytokine balance in the gastrocnemius of rats with heart failure. Brazilian Journal of Physical Therapy. 2018; 22(2):154-60. [DOI:10.1016/j.bjpt.2017.09.004] [PMID] [PMCID]
42.Puhl SL, Müller A, Wagner M, Devaux Y, Böhm M, Wagner DR, et al. Exercise attenuates inflammation and limits scar thinning after myocardial infarction in mice. American Journal of Physiology. Heart and Circulatory Physiology. 2015; 309(2):H345-59. [DOI:10.1152/ajpheart.00683.2014] [PMID]
متن کامل: (2087 مشاهده)
مقدمه
انفارکتوس میوکارد از علل اصلی مرگومیر بیماران قلبیعروقی، اولین علت مرگ در دنیا و عامل مرگ 7 میلیون نفر در سال 2016 بود [1]. پیشبینی شده است این بیماری تا سال 2030 منجربه مرگ نزدیک به 23/6 میلیون نفر در سال شود. بیش از 20 درصد از بیماران انفارکتوس میوکارد در سال اول پس از وقوع، بیماریشان مجدد بازگشته است و بیشترین افزایش سالهای زندگی ازدسترفته بهدلیل بیماری و مرگ را بهخود اختصاص میدهد [1]. ازاینرو انفارکتوس میوکارد با التهاب و ارتشاح سلولهای التهابی نمایان و درصورت عدم کاهش آن منجربه مرگ میشود. البته فعالشدن فرایند التهابی بلافاصله بعد از انفارکتوس میوکارد لازمه ورود بهمرحله ترمیم و تکثیر سلولی میباشد. با ایسکمی میوکارد پاسخ پیشالتهابی اولیه القاشده و منجر به از بین رفتن بقایای سلول نکروتیک از منطقه انفارکتوس میوکارد میشود [2]. از طرف دیگر، التهاب یک عامل زمینهای مهم جهت آغاز تشکیل پلاکهای کرونری، توسعه ناپایداری و نیز پارگی آنها نیز به حساب میآید. همچنین، پاسخهای التهابی مداوم میتواند اثرات سوئی بر عملکرد بطن چپ و فرآیند بازسازی پس از انفارکتوس میوکارد داشته باشد [3].
گزارشات کلینیکی نشان دادهاند که واکنشهای التهابی پس از انفارکتوس میوکارد میتواند بروز تصلب عروقی را تسریع کند و باعث وقوع مجدد انفارکتوس میوکارد شود [4]. بنابراین کنترل هرچه سریعتر التهاب ناشی از وقوع انفارکتوس میوکارد ضروری است. پنترواکسین-3 و استئوپروتگرین ازجمله این عوامل التهابی در بیماران قلبی میباشند که در پژوهش حاضر مورد بررسی قرار گرفته است. PTX3 پروتئین زنجیره بلند متعلق به خانواده پنتراکسینها است که اخیراً کشف شده است. این پروتئین بهصورت ناحیهای در محل التهاب و در انواع مختلف سلولهای عضله اسکلتی، مونوسیتها، ماکروفاژها، سلولهای اندوتلیال، دیواره عضلات صاف و همچنین در زخمهای آترواسکلروتیک در پاسخ به تحریک التهابی ترشح میشود [5].
در مطالعات پیشین از پروتئین واکنشگر-C-C(CRP) بهعنوان قویترین پیشبین کننده بیماریهای قلبیعروقی یاد شده است؛ اما اخیراً مطالعات نشان دادهاند که PTX3 نسبت به CRP فاکتور پیشبین کننده قویتر و با شدت بالایی برای بیماران قلبیعروقی بوده است [6]. التهاب بیش از حد بیماران انفارکتوس میوکارد رابطه مستقیمی با پروتئین PTX3 دارد [7]. پروتئین OPG یک نشانگر التهابی 401 آمینواسیدی است که در ارتباط با مشکلات قلبیعروقی بوده و با افزایش خطر، زخمهای آترواسکلروسیز در جمعیت عامه همراه هست. OPG و لیگاند آن بهنام فعالگر گیرنده لیگاند کاپای بتا فاکتور نوکلئار، یک گلیکوپروتئین محلول 380 آمینواسیدی چند وجهی از خانواده گیرنده فاکتور نکروز تومور و متصل به فعالکننده گیرنده لیگاند کاپا-بتا فاکتور هستهای میباشد. [8]. این پروتئین از عوامل بالقوه تنظیمی جدیدی هست که در اختلال عملکرد اندوتلیال و پاتوژنز قلبیعروقی دخیل است [9]. همچنین در فعالیتهای التهابی، استرس بیومکانیکی، کالسیفیکاسون کرونری، کاهش عملکرد انقباضی، فعالیت ضد آپوپتوز، بیماریهای نارسایی احتقاق قلبی، اختلال فشار خونی دیابتیها، بیماری شریان کرونر، بیماریهای محیطی و عروق مغزی و خطر قلبیعروقی بیماران مبتلا به سندرم متابولیک نقش دارد. علاوهبر درمانهای پزشکی بیماران انفارکتوس میوکارد روشهای متفات دیگری در طب مکمل در مواجهه با ناراحتیهای قلبیعروقی وجود دارد. انجام تمرینات ورزشی از اولین توصیهها برای پیشگیری و بازتوانی این بیماری میباشد [10]. تمرین بدنی منجر به بهبود عملکرد قلبی و احیای نکروتیکی مایوکاردیوم میشود و بعد انفارکتوس میوکارد با اکسیژناسیون میوکارد و بازسازی بطن از وقوع حوادث بعدی سکته قلبی جلوگیری میکند [11]. باوجوداین، مکانیسمهای اثرگذار بر این روند بهویژه بعد از سکته قلبی بهطور کامل روشن نشده است. فوکادا و همکاران نشان دادند 3 تا 6 ماه تمرین استقامتی بیماران با نارسایی قلبی و کاردیومیوپاتی، منجر به کاهش معنادار سطوح PTX3 شد [12]. همچنین بساطی و همکاران نیز در مطالعه خود گزارش کردند فعالیت ورزشی هوازی سطوح پلاسمایی PTX3 بیماران کرونری دیابتی و غیردیابتی را کاهش میدهد [13].
در گزارش اسپاندر و همکاران نشان داده شد تمرین استقامتی بیمارن قلبی گلیکوپروتئین OPG را تغییرات معناداری نداد [14] که با نتایج جی و همکاران همسو بود [15]. بحث عوامل التهابی PTX3 و OPG در سیستم ایمنی و التهابی و پاسخ آنها بهتمرینات بازتوانی فزآینده کاملاً جدید است. بههرحال در مطالعات مختلف اثرات مثبت تمرینات ورزشی بر جنبههای مختلف سلامت قلب بیماران مبتلا به انفارکتوس میوکارد موردتوجه قرار گرفته است، اما سازوکارهای فیزیولوژیک با رویکرد التهابی در آنها بهخوبی روشن نیست.
محققان مطالعه حاضر تأثیر یک دوره بازتوانی ورزشی فزآینده را بر سطوح سرمی PTX3 و OPG موشهای صحرایی انفارکته را مورد بررسی قرار دادند.
مواد و روشها
در این پژوهش کنترلشده با پسآزمون از 36 سر موش صحرایی نر نژاد ویستار 8 هفتهای با میانگین وزنی 26±210 گرم که از انستیتو پاستور تهران خریداری شده بود، استفاده شد. این حیوانات در قفسهای پلیکربنات شفاف و در شرایط کنترلشده محیطی با دمای 2±22 درجه سانتیگراد، رطوبت 5±50 و چرخه روشنایی-تاریکی 12:12 ساعت با دسترسی آزاد به آب و غذای ویژه موشهای صحرایی نگهداری شدند. پس از انتقال حیوانات به محیط پژوهش بهمدت 1 هفته در شرایط جدید نگهداری شدند و پس از سازگاری با محیط آزمایشگاه بهطور تصادفی به 3 گروه 12تایی سالم ، انفارکتوس میوکارد و انفارکتوس میوکارد-بازتوانی ورزشی تقسیم شدند.
پرتکل القای انفارکتوس میوکارد
برای القای انفارکتوس میوکارد از تزریق زیرجلدی ایزوپروترونول (ISO ساخت شرکت سیگما آمریکا) با دُز 150 میلیگرم بهازای هر کیلوگرم وزن بدن استفاده شد [16]. ایزوپروترونول با محلول نرمال سالین (0/05 سیسی) رقیق شد و در 2 روز متوالی با فاصله 24 ساعت به موشهای صحرایی تزریق شد. این ماده در مدلهای حیوانی بهویژه موشهای صحرایی یکی از روشهای رایج القای انفارکتوس میوکارد است [17]. بعد از گذشت 48 ساعت از آخرین تزریق از هر گروه چند موش صحرایی بهصورت تصادفی انتخاب و تحت شرایط آزمایش جهت اطمینان از القای انفارکتوس قرار گرفت. در این مطالعه انفارکتوس قلبی براساس تغییـرات الکتروکـاردیوگرافی (بالا رفتن قطعه ST) همـراه بـا افزایش آنزیم قلبی cTnI (344/01 پیکوگرم/میلیلیتر) تأیید شد (تصویر شماره 1).
انفارکتوس میوکارد از علل اصلی مرگومیر بیماران قلبیعروقی، اولین علت مرگ در دنیا و عامل مرگ 7 میلیون نفر در سال 2016 بود [1]. پیشبینی شده است این بیماری تا سال 2030 منجربه مرگ نزدیک به 23/6 میلیون نفر در سال شود. بیش از 20 درصد از بیماران انفارکتوس میوکارد در سال اول پس از وقوع، بیماریشان مجدد بازگشته است و بیشترین افزایش سالهای زندگی ازدسترفته بهدلیل بیماری و مرگ را بهخود اختصاص میدهد [1]. ازاینرو انفارکتوس میوکارد با التهاب و ارتشاح سلولهای التهابی نمایان و درصورت عدم کاهش آن منجربه مرگ میشود. البته فعالشدن فرایند التهابی بلافاصله بعد از انفارکتوس میوکارد لازمه ورود بهمرحله ترمیم و تکثیر سلولی میباشد. با ایسکمی میوکارد پاسخ پیشالتهابی اولیه القاشده و منجر به از بین رفتن بقایای سلول نکروتیک از منطقه انفارکتوس میوکارد میشود [2]. از طرف دیگر، التهاب یک عامل زمینهای مهم جهت آغاز تشکیل پلاکهای کرونری، توسعه ناپایداری و نیز پارگی آنها نیز به حساب میآید. همچنین، پاسخهای التهابی مداوم میتواند اثرات سوئی بر عملکرد بطن چپ و فرآیند بازسازی پس از انفارکتوس میوکارد داشته باشد [3].
گزارشات کلینیکی نشان دادهاند که واکنشهای التهابی پس از انفارکتوس میوکارد میتواند بروز تصلب عروقی را تسریع کند و باعث وقوع مجدد انفارکتوس میوکارد شود [4]. بنابراین کنترل هرچه سریعتر التهاب ناشی از وقوع انفارکتوس میوکارد ضروری است. پنترواکسین-3 و استئوپروتگرین ازجمله این عوامل التهابی در بیماران قلبی میباشند که در پژوهش حاضر مورد بررسی قرار گرفته است. PTX3 پروتئین زنجیره بلند متعلق به خانواده پنتراکسینها است که اخیراً کشف شده است. این پروتئین بهصورت ناحیهای در محل التهاب و در انواع مختلف سلولهای عضله اسکلتی، مونوسیتها، ماکروفاژها، سلولهای اندوتلیال، دیواره عضلات صاف و همچنین در زخمهای آترواسکلروتیک در پاسخ به تحریک التهابی ترشح میشود [5].
در مطالعات پیشین از پروتئین واکنشگر-C-C(CRP) بهعنوان قویترین پیشبین کننده بیماریهای قلبیعروقی یاد شده است؛ اما اخیراً مطالعات نشان دادهاند که PTX3 نسبت به CRP فاکتور پیشبین کننده قویتر و با شدت بالایی برای بیماران قلبیعروقی بوده است [6]. التهاب بیش از حد بیماران انفارکتوس میوکارد رابطه مستقیمی با پروتئین PTX3 دارد [7]. پروتئین OPG یک نشانگر التهابی 401 آمینواسیدی است که در ارتباط با مشکلات قلبیعروقی بوده و با افزایش خطر، زخمهای آترواسکلروسیز در جمعیت عامه همراه هست. OPG و لیگاند آن بهنام فعالگر گیرنده لیگاند کاپای بتا فاکتور نوکلئار، یک گلیکوپروتئین محلول 380 آمینواسیدی چند وجهی از خانواده گیرنده فاکتور نکروز تومور و متصل به فعالکننده گیرنده لیگاند کاپا-بتا فاکتور هستهای میباشد. [8]. این پروتئین از عوامل بالقوه تنظیمی جدیدی هست که در اختلال عملکرد اندوتلیال و پاتوژنز قلبیعروقی دخیل است [9]. همچنین در فعالیتهای التهابی، استرس بیومکانیکی، کالسیفیکاسون کرونری، کاهش عملکرد انقباضی، فعالیت ضد آپوپتوز، بیماریهای نارسایی احتقاق قلبی، اختلال فشار خونی دیابتیها، بیماری شریان کرونر، بیماریهای محیطی و عروق مغزی و خطر قلبیعروقی بیماران مبتلا به سندرم متابولیک نقش دارد. علاوهبر درمانهای پزشکی بیماران انفارکتوس میوکارد روشهای متفات دیگری در طب مکمل در مواجهه با ناراحتیهای قلبیعروقی وجود دارد. انجام تمرینات ورزشی از اولین توصیهها برای پیشگیری و بازتوانی این بیماری میباشد [10]. تمرین بدنی منجر به بهبود عملکرد قلبی و احیای نکروتیکی مایوکاردیوم میشود و بعد انفارکتوس میوکارد با اکسیژناسیون میوکارد و بازسازی بطن از وقوع حوادث بعدی سکته قلبی جلوگیری میکند [11]. باوجوداین، مکانیسمهای اثرگذار بر این روند بهویژه بعد از سکته قلبی بهطور کامل روشن نشده است. فوکادا و همکاران نشان دادند 3 تا 6 ماه تمرین استقامتی بیماران با نارسایی قلبی و کاردیومیوپاتی، منجر به کاهش معنادار سطوح PTX3 شد [12]. همچنین بساطی و همکاران نیز در مطالعه خود گزارش کردند فعالیت ورزشی هوازی سطوح پلاسمایی PTX3 بیماران کرونری دیابتی و غیردیابتی را کاهش میدهد [13].
در گزارش اسپاندر و همکاران نشان داده شد تمرین استقامتی بیمارن قلبی گلیکوپروتئین OPG را تغییرات معناداری نداد [14] که با نتایج جی و همکاران همسو بود [15]. بحث عوامل التهابی PTX3 و OPG در سیستم ایمنی و التهابی و پاسخ آنها بهتمرینات بازتوانی فزآینده کاملاً جدید است. بههرحال در مطالعات مختلف اثرات مثبت تمرینات ورزشی بر جنبههای مختلف سلامت قلب بیماران مبتلا به انفارکتوس میوکارد موردتوجه قرار گرفته است، اما سازوکارهای فیزیولوژیک با رویکرد التهابی در آنها بهخوبی روشن نیست.
محققان مطالعه حاضر تأثیر یک دوره بازتوانی ورزشی فزآینده را بر سطوح سرمی PTX3 و OPG موشهای صحرایی انفارکته را مورد بررسی قرار دادند.
مواد و روشها
در این پژوهش کنترلشده با پسآزمون از 36 سر موش صحرایی نر نژاد ویستار 8 هفتهای با میانگین وزنی 26±210 گرم که از انستیتو پاستور تهران خریداری شده بود، استفاده شد. این حیوانات در قفسهای پلیکربنات شفاف و در شرایط کنترلشده محیطی با دمای 2±22 درجه سانتیگراد، رطوبت 5±50 و چرخه روشنایی-تاریکی 12:12 ساعت با دسترسی آزاد به آب و غذای ویژه موشهای صحرایی نگهداری شدند. پس از انتقال حیوانات به محیط پژوهش بهمدت 1 هفته در شرایط جدید نگهداری شدند و پس از سازگاری با محیط آزمایشگاه بهطور تصادفی به 3 گروه 12تایی سالم ، انفارکتوس میوکارد و انفارکتوس میوکارد-بازتوانی ورزشی تقسیم شدند.
پرتکل القای انفارکتوس میوکارد
برای القای انفارکتوس میوکارد از تزریق زیرجلدی ایزوپروترونول (ISO ساخت شرکت سیگما آمریکا) با دُز 150 میلیگرم بهازای هر کیلوگرم وزن بدن استفاده شد [16]. ایزوپروترونول با محلول نرمال سالین (0/05 سیسی) رقیق شد و در 2 روز متوالی با فاصله 24 ساعت به موشهای صحرایی تزریق شد. این ماده در مدلهای حیوانی بهویژه موشهای صحرایی یکی از روشهای رایج القای انفارکتوس میوکارد است [17]. بعد از گذشت 48 ساعت از آخرین تزریق از هر گروه چند موش صحرایی بهصورت تصادفی انتخاب و تحت شرایط آزمایش جهت اطمینان از القای انفارکتوس قرار گرفت. در این مطالعه انفارکتوس قلبی براساس تغییـرات الکتروکـاردیوگرافی (بالا رفتن قطعه ST) همـراه بـا افزایش آنزیم قلبی cTnI (344/01 پیکوگرم/میلیلیتر) تأیید شد (تصویر شماره 1).
پرتکل بازتوانی ورزشی فزآینده
مرحله آشناسازی موشهای صحرایی با تردمیل در هفته دوم، بهمدت 1 هفته، هفتهای 5 روز، هر روز بهمدت 10 دقیقه و با سرعت 10 متر/دقیقه انجام شد [18]. بررسیها نشان داده است که این میزان تمرین در حدی نیست که منجر به تغییر بارزی در ظرفیت هوازی نمونهها شود. موشهای صحرایی برای دویدن ازطریق صدا و تحریک شرطیسازی شدند تا از نزدیک شدن، استراحت و برخورد با بخش شوک الکتریکی در بخش انتهای دستگاه خودداری کنند. برنامه تمرین هوازی فزآینده شامل 8 هفته دویدن روی نوارگردان، در 3 روز غیرمتوالی با مدت 20 دقیقه و سرعت 12متر در دقیقه آغاز شد. در ادامه تمرین، هر هفته 5 دقیقه بهمدت تمرین اضافه شد تا به 50 دقیقه رسید (جدول شماره 1).

همچنین سرعت تردمیل در هر هفته 1متر در دقیقه اضافه شد تا درنهایت به 18 متر در دقیقه افزایش یافت. این برنامه تمرینی با شیب صفر بوده که با 3 دقیقه گرم کردن و سرد کردن با سرعت 7 متر در دقیقه انجام شد [19].
خونگیری و ارزیابی بیوشیمیایی
گروهها بلافاصله پس از پایان پروتکل تمرینی با ترکیبی از کتامین (75 میلیگرم/کیلوگرم) و زایلازین (10 میلیگرم/کیلوگرم) بیهوش و کشته شدند. در مراحل مختلف ضمن رعایت مسائل اخلاقی سعی شد از هرگونه آزار جسمی و روشهای غیرضروری اجتناب شود. عمل خونگیری بعد از بیهوشی، مستقیم از دهلیز سمت راست قلب موشهای صحرایی با سرنگهای تیوبدار 10 سیسی صورت گرفت. خون گرفتهشده در لولههای ژلدار کلاته ساده ریخته شد و پس از قرارگرفتن بهمدت 10 دقیقه در شرایط دمای محیط و لخته زدن، در سانتریفوژ برای 5 دقیقه و با 5000 دور در دقیقه گذاشته شد. سپس نمونههای سرمی برای تحلیل بیوشیمیایی در دمای 80- درجه سانتیگراد قرار داده شدند. جهت تعیین مقادیر سرمی PTX3 و OPG از روش الایزا و براساس دستورالعمل کارخانه سازنده کیتهای شرکت ایستبیوفارم چین (با ضریب تغییرات برونآزمونی کمتر از 10 درصد برای هر 2 کیت و حساسیت روش اندازهگیری بهترتیب 0/1 و 0/03 نانوگرم/میلیلیتر) استفاده شد.
تجزیه و تحلیل آماری
پس از تأیید توزیع نرمال دادهها با استفاده از آزمون شاپیرو-ویلک، برای مقایسه میانگین بین گروهها، از آزمون آنوای (یکطرفه) استفاده شد. تجزیهوتحلیلهای آماری با استفاده از نسخه 7 نرمافزار آماری گرافپد در سطح معناداری (0/05>P) و سطح اطمینان 95 درصد انجام شد.
یافتهها
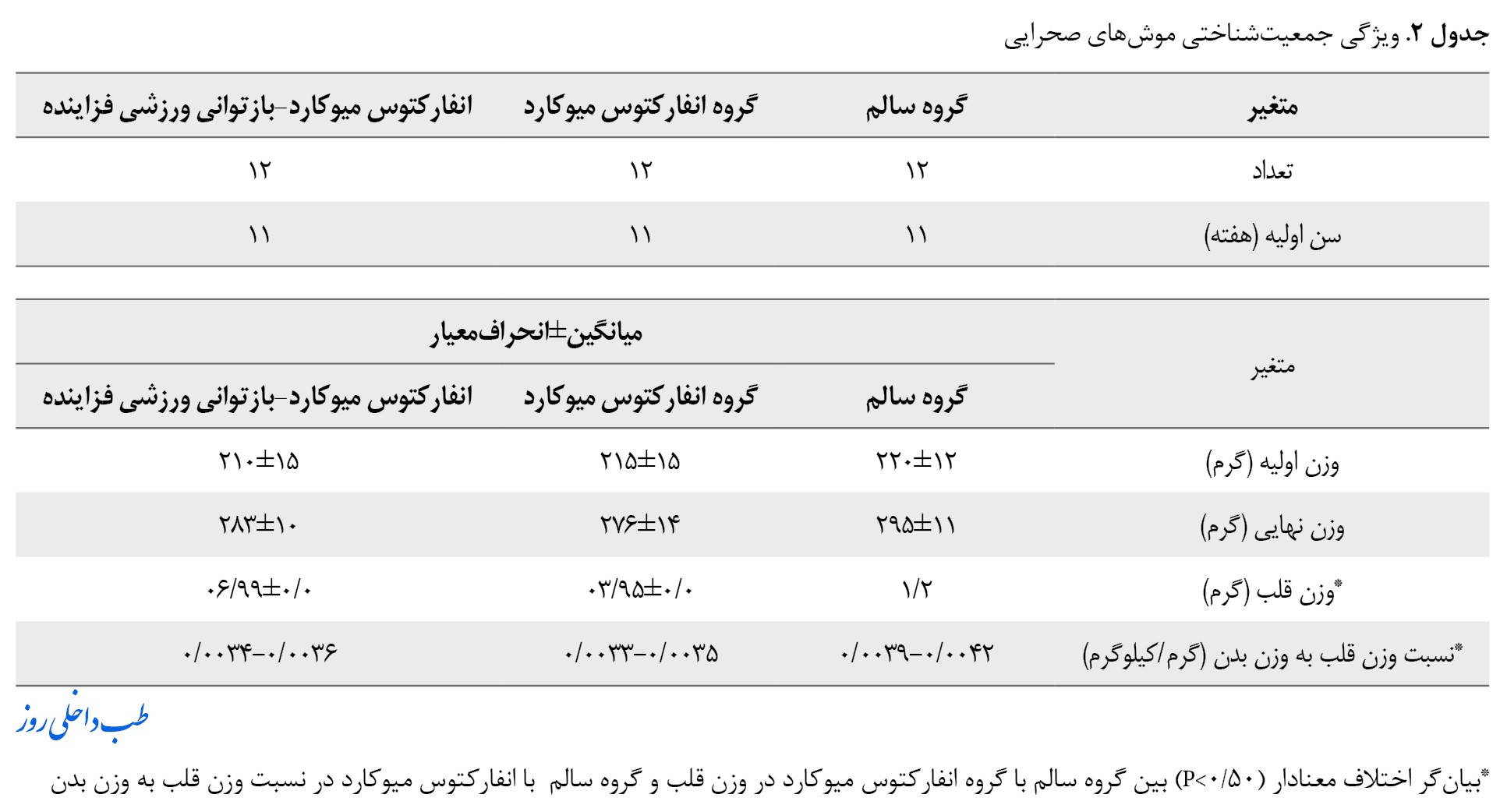
بعد از القای انفارکتوس میوکارد و پایان تحقیق وزن بدن موشهای صحرایی در کلیه گروهها اندازهگیری شد. نتایج تغییرات معنادار در گروه وزن اولیه بعد از القا و وزن نهایی در بین گروهها نشان نداد (3/1=F و 057/P=0 و 2/3=F و 157/P=0). همچنین وزن قلب موشهای صحرایی بعد از مداخله در کلیه گروهها موردمطالعه قرار گرفت و نتایج تغییرات معناداری بین گروه سالم و انفارکتوس میوکارد نشان داد (4/3=F و 04/P=0). همچنین نسبت قلب به وزن بدن بین گروه انفارکتوس میوکارد با گروههای سالم و بازتوانی ورزشی فزآینده نیز تفاوت معناداری داشت (5/3=F و 047/P=0) (جدول شماره 2).
تصویر شماره 2 غلظت سرمی PTX3 در گروههای موردمطالعه پس از انجام مداخله را نشان میدهد.
مرحله آشناسازی موشهای صحرایی با تردمیل در هفته دوم، بهمدت 1 هفته، هفتهای 5 روز، هر روز بهمدت 10 دقیقه و با سرعت 10 متر/دقیقه انجام شد [18]. بررسیها نشان داده است که این میزان تمرین در حدی نیست که منجر به تغییر بارزی در ظرفیت هوازی نمونهها شود. موشهای صحرایی برای دویدن ازطریق صدا و تحریک شرطیسازی شدند تا از نزدیک شدن، استراحت و برخورد با بخش شوک الکتریکی در بخش انتهای دستگاه خودداری کنند. برنامه تمرین هوازی فزآینده شامل 8 هفته دویدن روی نوارگردان، در 3 روز غیرمتوالی با مدت 20 دقیقه و سرعت 12متر در دقیقه آغاز شد. در ادامه تمرین، هر هفته 5 دقیقه بهمدت تمرین اضافه شد تا به 50 دقیقه رسید (جدول شماره 1).

همچنین سرعت تردمیل در هر هفته 1متر در دقیقه اضافه شد تا درنهایت به 18 متر در دقیقه افزایش یافت. این برنامه تمرینی با شیب صفر بوده که با 3 دقیقه گرم کردن و سرد کردن با سرعت 7 متر در دقیقه انجام شد [19].
خونگیری و ارزیابی بیوشیمیایی
گروهها بلافاصله پس از پایان پروتکل تمرینی با ترکیبی از کتامین (75 میلیگرم/کیلوگرم) و زایلازین (10 میلیگرم/کیلوگرم) بیهوش و کشته شدند. در مراحل مختلف ضمن رعایت مسائل اخلاقی سعی شد از هرگونه آزار جسمی و روشهای غیرضروری اجتناب شود. عمل خونگیری بعد از بیهوشی، مستقیم از دهلیز سمت راست قلب موشهای صحرایی با سرنگهای تیوبدار 10 سیسی صورت گرفت. خون گرفتهشده در لولههای ژلدار کلاته ساده ریخته شد و پس از قرارگرفتن بهمدت 10 دقیقه در شرایط دمای محیط و لخته زدن، در سانتریفوژ برای 5 دقیقه و با 5000 دور در دقیقه گذاشته شد. سپس نمونههای سرمی برای تحلیل بیوشیمیایی در دمای 80- درجه سانتیگراد قرار داده شدند. جهت تعیین مقادیر سرمی PTX3 و OPG از روش الایزا و براساس دستورالعمل کارخانه سازنده کیتهای شرکت ایستبیوفارم چین (با ضریب تغییرات برونآزمونی کمتر از 10 درصد برای هر 2 کیت و حساسیت روش اندازهگیری بهترتیب 0/1 و 0/03 نانوگرم/میلیلیتر) استفاده شد.
تجزیه و تحلیل آماری
پس از تأیید توزیع نرمال دادهها با استفاده از آزمون شاپیرو-ویلک، برای مقایسه میانگین بین گروهها، از آزمون آنوای (یکطرفه) استفاده شد. تجزیهوتحلیلهای آماری با استفاده از نسخه 7 نرمافزار آماری گرافپد در سطح معناداری (0/05>P) و سطح اطمینان 95 درصد انجام شد.
یافتهها
بعد از القای انفارکتوس میوکارد و پایان تحقیق وزن بدن موشهای صحرایی در کلیه گروهها اندازهگیری شد. نتایج تغییرات معنادار در گروه وزن اولیه بعد از القا و وزن نهایی در بین گروهها نشان نداد (3/1=F و 057/P=0 و 2/3=F و 157/P=0). همچنین وزن قلب موشهای صحرایی بعد از مداخله در کلیه گروهها موردمطالعه قرار گرفت و نتایج تغییرات معناداری بین گروه سالم و انفارکتوس میوکارد نشان داد (4/3=F و 04/P=0). همچنین نسبت قلب به وزن بدن بین گروه انفارکتوس میوکارد با گروههای سالم و بازتوانی ورزشی فزآینده نیز تفاوت معناداری داشت (5/3=F و 047/P=0) (جدول شماره 2).

تصویر شماره 2 غلظت سرمی PTX3 در گروههای موردمطالعه پس از انجام مداخله را نشان میدهد.
نتایج نشان داد القای انفارکتوس میوکارد منجر به افزایش معنادار سطوح سرمی PTX3 موشهای صحرایی در گروههای آزمایش نسبت به گروه سالم شد (0/0001=P با 13=F). آزمون توکی این تفاوت را بین گروههای سالم با انفارکتوس میوکارد (9=F و 0001/P=0)، سالم با بازتوانی ورزشی فزاینده (5/5=F و 002/P=0) و انفارکتوس میوکارد با بازتوانی ورزشی فزاینده نشان داد (F=3/63 و 04/P=0).
تصویر شماره 3 غلظت سرمی OPG در گروههای موردمطالعه پس از انجام مداخله را نشان میدهد.
تصویر شماره 3 غلظت سرمی OPG در گروههای موردمطالعه پس از انجام مداخله را نشان میدهد.
نتایج نشان داد سطوح سرمی OPG موشهای صحرایی افزایش آماری معناداری در گروههای آزمایش نسبت به گروه سالم داشت (P=0/0001 با 4/5=F). آزمون توکی این تفاوت را بین گروههای سالم با انفارکتوس میوکارد (10=F و 0001/P=0)، سالم با بازتوانی ورزشی فزاینده (5/4=F و 002/P=0) و انفارکتوس میوکارد با بازتوانی ورزشی فزاینده (4/5=F و 01/P=0) نشان داد.
بحث
این مطالعه بهمنظور بررسی تغییرات غلظت سرمی PTX3 و OPG موشهای صحرایی انفارکته پس از بازتوانی ورزشی انجام شد. یافتههای تحقیق نشان دادند القای انفارکتوس میوکارد موجب افزایش معنادار سطوح سرمی PTX3 و OPG نمونههای انفارکتوسی شد. نتایج پژوهش حاضر نشان میدهد 8 هفته تمرین بازتوانی استقامتی فزآینده مقادیر سرمی PTX3 و OPG نمونههای انفارکته را کاهش داد. همچنین وزن اولیه و نهایی گروهها نسبت به گروه سالم کاهش غیرمعناداری داشت، اما وزن قلب و نسبت وزن قلب به بدن کاهش معناداری در گروه انفارکتوس میوکارد نسبت به گروه سالم نشان داد. انفارکتوس قلبی با ایجاد ایسکمی باعث غیرعادی شدن عملکرد قلب و نکروز کاردیومایوسیت میشود. همچنین هایپرتروفی پاتولوژیک بطن چپ، کاهش تراکم مویرگی و افزایش التهاب را با رهایش پروتئینهای مولکولی مرتبط با آسیب از سلولهای نکروزه بهدنبال دارد [12، 20].
باتوجهبه اینکه پاسخهای التهابی در مراحل اولیه انفارکتوس میوکارد، سلولهای مرده انفارکتوسی و بقایای ماتریکس را پاکسازی میکنند و توسط میوفیبروبلاستها و سلولهای عروقی فرایندهای ترمیمی را فعال میکنند، اما همچنین ممکن است بهتشکیل بافت اسکار، بازآرایی فیبروتیک، آپوپتوز قلب و اعمال آریتموژنیک کمک کنند [21]. التهاب طولانی و بیش از حد در پاتوژنز عوارض و توسعه نارسایی قلبی پس از انفارکتوس نقش برجستهای دارد. از اینرو مداخلاتی که بهکاهش علائم التهابی منجر شود یکی از اولویتهای برنامههای بازتوانی قلبی است. طی چندسال گذشته، نشانگرهای زیستی نقش مهمی در پیشبینی خطرات قلبی عروقی داشتهاند [22]. تاکنون مکانیسمهای مولکولی زمینهساز اثرات محافظتی و بهبود بازسازی در تمرینات ورزشی پس از انفارکتوس میوکارد بهخوبی روشن نشده است. در مطالعات جدید PTX3 بهعنوان یکی از قویترین پیشبینیکننده بیماریهای قلبیعروقی یاد شده است [6]. همچنین پروتئین OPG نیز در ارتباط با بیماران انفارکتوس میوکارد و عروق کرونر میباشد و با افزایش خطر زخمهای قلبی در جوامع عمومی همراه میباشد [23]. بیان تصلب شرایین و انفارکتوس میوکارد با بالارفتن مرگومیر ناشی از التهاب مرتبط است. التهاب، استرس مکانیکی، کاهش عملکرد انقباضی و بیماریهای نارسایی قلبی منجربه بیان ژنهای PTX3 و OPG از زخمهای آترواسکلروتیک، مونوسیتها، ماکروفاژها و اندوتلیال بیماران قلبی میشود [6، 10].
در مطالعات انجامشده بر بیماران انفارکتوس میوکارد، گزارش شده است که تمرین هوازی از تغییرات منفی التهابی قلبی جلوگیری میکند و یافتههای ناشی از تحقیق ذیل را تأیید میکند [24]. در تحقیق حاضر وزن اولیه موشهای صحرایی کاهش غیرمعناداری و وزنهای پایانی گروهها تفاوت معناداری نشان نداد. دلیل کاهش وزن اولیه بعد از القای انفارکتوس را میتوان در کاهش مصرف غذای حیوانات بهدلیل القای ایزوپروترونول دانست [25]. وزن قلب موشهای صحرایی بعد از تزریق ایزوپزوترونول بهطور معنادار نسبت به عدم تغییر وزن کل در گروه انفارکتوس میوکارد نسبت به گروه سالم کاهش یافت که با نتایج تحقیق امیرسردار و همکاران همسو میباشد [26]. همچنین تمرینات استقامتی فزآینده منجر به افزایش وزن قلب و نسبت وزن قلب به وزن کل بدن موشهای صحرای نسبت به گروه انفارکتوس میوکارد شدکه با پژوهشهای دیگر همراستا بود [27, 28]. یافته دیگر تحقیق حاضر نشان داد القای انفارکتوس قلبی منجر به افزایش معنادار سطوح سرمی PTX3 نسبت به گروه سالم میشود. نتایج بهدستآمده از بازتوانی ورزشی فزآینده پس از القای انفارکتوس میوکارد کاهش معناداری در سطوح سرمی PTX3 داشت. تانک اتا و همکاران نشان دادند یک دوره تمرینات ورزشی با کاهش معنادار PTX3 همراه است [29]. در همین راستا، فوکودا و همکاران به بررسی بازتوانی ورزشی بیماران قلبی پرداختند و گزارش کردند غلظت PTX3 کاهش معناداری داشت [12].
در تحقیقی دیگر گزارش شد فعالیت ورزشی هوازی سطوح پلاسمایی PTX3 بیماران کرونری دیابتی و غیر دیابتی را کاهش میدهد [13] که با نتایج تحقیق فوق در یک راستا بوده است. در تضاد با پژوهش حاضر ناکاجیما و همکاران بهبررسی ترشح PTX3 بهعنوان مارکر التهابی مستقل در طول تمرین شدید پرداختند. نتایج این مطالعه نشان داد ورزش با شدت بالا موجب افزایش پلاسمایی PTX3 بهواسطه تمرینات ورزشی میشود [30]. میاکی و همکاران نیز در تحقیق خود به این نتیجه رسیدند که تمرین هوازی منظم موجب افزایش غلظت PTX3 پلاسما با بهبود HDL، اوج جذب اکسیژن و انبساط شریان در زنان یائسه میشود [7]. نوع و شدت پروتکل بازتوانی، وضعیت سلامت و بیماری نمونهها و جنسیت میتواند دلیل تناقض بهوجودآمده باشد. پژوهش حاضر در نمونههای انفارکته، با پروتکل تمرینی فزآینده و موشهای صحرایی نر انجام شد. در توجیه اثرپذیری تمرینات ورزشی بر PTX3 میتوان گفت پنتراکسینها ازطریق واکنشهای گوناگونی در تنظیم پاسخهای التهابی شرکت میکنند. تمرین ورزشی منجر به تحریک تعامل PTX3 با پی-سلکتین میشود [31]. این تعامل در پاسخ بهمحرک التهابی، انباشت نوتروفیلها را متوقف میکند و با سازوکار بازخورد منفی، فراخوانی اولیه نوتروفیلها را کنترل میکند. بنابراین بهعنوان یک تنطیمکننده ذاتی پاسخ التهابی اولیه عمل میکند و احتمالا آسیب بافتی شدید ناشی از التهاب انفارکتوس میوکارد را کاهش میدهد [31]. همچنین PTX3 باعث افزایش فعالسازی عامل رشد تغییر شکلدهنده بتا میشود و پاسخهای ضدالتهابی در ماکروفاژها را القا میکند [32].
ازآنجاکه القای بیان PTX3 از راه مسیرPI3K/Akt تأثیر آتروپروتکتیک دارد، تعدیل مثبت PTX3 مانع از فعالشدن مسیرهای آبشار التهابی میشود و از آسیب دیواره عروق قلبی محافظت میکند [33]. بنابراین با القای انفارکتوس و افزایش PTX3 اثرات ضدالتهابی بیشتری نسبت به برخی تحقیقات دیگر دیده شده [7، 30] و انجام تمرینات ورزشی منجر به کاهش PTX3 و درنهایت کاهش التهاب بیماران قلبی میشود [34]. از دیگر نتایج مطالعه حاضر افزایش معناداری سطوح سرمی OPG موشهای صحرای القاشده با ISO بود. بررسی بیومارکر OPG پس از بازتوانی ورزشی فزآینده کاهش معناداری نسبت به گروه انفارکتوس میوکارد نشان داد. درخصوص پروتئین OPG جییون و همکاران در تحقیق خود نشان دادند تمرینات ترکیبی منجر به کاهش معنادار بیان پروتئین OPG میشود [15].
همسو با نتایج فوق اسپاندر و همکاران نیز گزارش کردند تمرینات استقامتی بر روی افرادی که حداقل یک مورد از فاکتورهای مرتبط با بیماری قلبی مانند اضافه وزن، هایپرتنشن، فشارخون، دیسلیپیدی، دیابت، سیگاری و سابقه ناراحتی را داشتند، نشان دادند گلیکوپروتئین OPG با کاهش همراه بود [14]. همچنین پژوهش کولین و همکاران در برنامه تمرینی ورزشی بر سطوح سرمی OPG افراد با اضافه وزن و چاق کاهش آن را بیان کردند [35]. در تضاد با نتایج این تحقیق گائینی و همکاران افزیش بیان ژن OPG موشهای صحرایی را بعد تمرینات ورزشی را نشان دادند [36] که با نتایج دیگر مطالعه که منجر به افزایش OPG بهدنبال تمرینات ورزشی شد، همسو بود [37]. علت تناقض ایجادشده را میتوان به سالم بودن نمونههای تحقیق، تمرینات مقاومتی و جنسیت متفاوت مطالعات فوق اشاره کرد.
سیتوکاین OPG در فعالیت التهابی، اختلال عملکرد اندوتلیال، استرس بیومکانیکی، مرگومیرهای قلبیعروقی، احتقاق قلبی و بیماری شریان کرونری دخیل میباشد [9]. این پروتئین از سلولهای متفاوتی مانند قلب و عروق، دیواره شریانها، عضلات عروق صاف و سلولهای اندتلیوم ترشح میشود [38] در اندوتلیال سلولها OPG بهواسطه تحریک TNF-α، IL1 و INF-α از گرانولها ترشح میشود. با این روش تزریق ISO منجر به افزایش مارکرهای فوق و درنهایت منجر به افزایش OPG در بیماران انفارکتوس قلبی میشود [39]. افرایش فاکتورهای التهابی منجر به تنطیم بالایی از RANKL از عضلات عروق و بهدنبال آن ترشح MMP و تخریب دیواره عروق و درنهایت ایجاد پلاک، ترمبوز و بیثبایت عملکرد قلبی میشود [40]. تمرینات ورزشی با کاهش فرایندهای التهابی و مهار مسیر بیانشده میتوانند منجر به کاهش مقادیر OPG و درنهایت بهبود علائم بالینی بیماران تحتمداخله بازتوانی ورزشی قلبی شوند [42]. بهنظر میرسد بیماری انفارکتوس میوکارد بهصورت درازمدت ثأثیرات خود را برجای میگذارد، شاید طول دوره پژوهش در تحقیق حاضر از محدودیتهای مهم برای بررسی دقیق اثرات تمرین ورزشی فزآینده بر این بیماری باشد. بنابراین توصیه میشود در مطالعات بعدی از بازه زمانی بیشتری استفاده شود.
نتیجهگیری
درمجموع یافتههای تحقیق فوق حاکی از کاهش سطوح سرمی PTX3 و OPG در گروه تمرینی را نشان میدهد. به نظر میرسد برای بهبود روند بیماران قلبی بازتوانی ورزشی فزآینده با کاهش التهاب بیماران مبتلا به انفارکتوس قلبی میتواند مزایای بالینی زیادی همراه داشته باشد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
در این پژوهش انجام تمام برنامههای تجربی بر روی حیوانات آزمایشگاهی (آشناسازی، تمرین، بیهوشی و کشتن حیوان) برحسب قوانین کمیته اخلاق و پروتکل نحوه رفتار با حیوانات انجام شد. این تحقیق با کد IR.IAU.ARAK.REC.1397.007 در کمیته اخلاق پژوهشی دانشگاه علوم پزشکی اراک تصویب شده است.
حامی مالی
این مقاله برگرفته از رساله دکتری بابک امیرسرداری، گروه تربیت بدنی، دانشکده علوم ورزشی، دانشگاه آزاد اسلامی، واحد بروجرد است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از همکاری تمامی افرادی که در تحقیق حاضر شرکت داشتند، تشکر و قدردانی میشود.
بحث
این مطالعه بهمنظور بررسی تغییرات غلظت سرمی PTX3 و OPG موشهای صحرایی انفارکته پس از بازتوانی ورزشی انجام شد. یافتههای تحقیق نشان دادند القای انفارکتوس میوکارد موجب افزایش معنادار سطوح سرمی PTX3 و OPG نمونههای انفارکتوسی شد. نتایج پژوهش حاضر نشان میدهد 8 هفته تمرین بازتوانی استقامتی فزآینده مقادیر سرمی PTX3 و OPG نمونههای انفارکته را کاهش داد. همچنین وزن اولیه و نهایی گروهها نسبت به گروه سالم کاهش غیرمعناداری داشت، اما وزن قلب و نسبت وزن قلب به بدن کاهش معناداری در گروه انفارکتوس میوکارد نسبت به گروه سالم نشان داد. انفارکتوس قلبی با ایجاد ایسکمی باعث غیرعادی شدن عملکرد قلب و نکروز کاردیومایوسیت میشود. همچنین هایپرتروفی پاتولوژیک بطن چپ، کاهش تراکم مویرگی و افزایش التهاب را با رهایش پروتئینهای مولکولی مرتبط با آسیب از سلولهای نکروزه بهدنبال دارد [12، 20].
باتوجهبه اینکه پاسخهای التهابی در مراحل اولیه انفارکتوس میوکارد، سلولهای مرده انفارکتوسی و بقایای ماتریکس را پاکسازی میکنند و توسط میوفیبروبلاستها و سلولهای عروقی فرایندهای ترمیمی را فعال میکنند، اما همچنین ممکن است بهتشکیل بافت اسکار، بازآرایی فیبروتیک، آپوپتوز قلب و اعمال آریتموژنیک کمک کنند [21]. التهاب طولانی و بیش از حد در پاتوژنز عوارض و توسعه نارسایی قلبی پس از انفارکتوس نقش برجستهای دارد. از اینرو مداخلاتی که بهکاهش علائم التهابی منجر شود یکی از اولویتهای برنامههای بازتوانی قلبی است. طی چندسال گذشته، نشانگرهای زیستی نقش مهمی در پیشبینی خطرات قلبی عروقی داشتهاند [22]. تاکنون مکانیسمهای مولکولی زمینهساز اثرات محافظتی و بهبود بازسازی در تمرینات ورزشی پس از انفارکتوس میوکارد بهخوبی روشن نشده است. در مطالعات جدید PTX3 بهعنوان یکی از قویترین پیشبینیکننده بیماریهای قلبیعروقی یاد شده است [6]. همچنین پروتئین OPG نیز در ارتباط با بیماران انفارکتوس میوکارد و عروق کرونر میباشد و با افزایش خطر زخمهای قلبی در جوامع عمومی همراه میباشد [23]. بیان تصلب شرایین و انفارکتوس میوکارد با بالارفتن مرگومیر ناشی از التهاب مرتبط است. التهاب، استرس مکانیکی، کاهش عملکرد انقباضی و بیماریهای نارسایی قلبی منجربه بیان ژنهای PTX3 و OPG از زخمهای آترواسکلروتیک، مونوسیتها، ماکروفاژها و اندوتلیال بیماران قلبی میشود [6، 10].
در مطالعات انجامشده بر بیماران انفارکتوس میوکارد، گزارش شده است که تمرین هوازی از تغییرات منفی التهابی قلبی جلوگیری میکند و یافتههای ناشی از تحقیق ذیل را تأیید میکند [24]. در تحقیق حاضر وزن اولیه موشهای صحرایی کاهش غیرمعناداری و وزنهای پایانی گروهها تفاوت معناداری نشان نداد. دلیل کاهش وزن اولیه بعد از القای انفارکتوس را میتوان در کاهش مصرف غذای حیوانات بهدلیل القای ایزوپروترونول دانست [25]. وزن قلب موشهای صحرایی بعد از تزریق ایزوپزوترونول بهطور معنادار نسبت به عدم تغییر وزن کل در گروه انفارکتوس میوکارد نسبت به گروه سالم کاهش یافت که با نتایج تحقیق امیرسردار و همکاران همسو میباشد [26]. همچنین تمرینات استقامتی فزآینده منجر به افزایش وزن قلب و نسبت وزن قلب به وزن کل بدن موشهای صحرای نسبت به گروه انفارکتوس میوکارد شدکه با پژوهشهای دیگر همراستا بود [27, 28]. یافته دیگر تحقیق حاضر نشان داد القای انفارکتوس قلبی منجر به افزایش معنادار سطوح سرمی PTX3 نسبت به گروه سالم میشود. نتایج بهدستآمده از بازتوانی ورزشی فزآینده پس از القای انفارکتوس میوکارد کاهش معناداری در سطوح سرمی PTX3 داشت. تانک اتا و همکاران نشان دادند یک دوره تمرینات ورزشی با کاهش معنادار PTX3 همراه است [29]. در همین راستا، فوکودا و همکاران به بررسی بازتوانی ورزشی بیماران قلبی پرداختند و گزارش کردند غلظت PTX3 کاهش معناداری داشت [12].
در تحقیقی دیگر گزارش شد فعالیت ورزشی هوازی سطوح پلاسمایی PTX3 بیماران کرونری دیابتی و غیر دیابتی را کاهش میدهد [13] که با نتایج تحقیق فوق در یک راستا بوده است. در تضاد با پژوهش حاضر ناکاجیما و همکاران بهبررسی ترشح PTX3 بهعنوان مارکر التهابی مستقل در طول تمرین شدید پرداختند. نتایج این مطالعه نشان داد ورزش با شدت بالا موجب افزایش پلاسمایی PTX3 بهواسطه تمرینات ورزشی میشود [30]. میاکی و همکاران نیز در تحقیق خود به این نتیجه رسیدند که تمرین هوازی منظم موجب افزایش غلظت PTX3 پلاسما با بهبود HDL، اوج جذب اکسیژن و انبساط شریان در زنان یائسه میشود [7]. نوع و شدت پروتکل بازتوانی، وضعیت سلامت و بیماری نمونهها و جنسیت میتواند دلیل تناقض بهوجودآمده باشد. پژوهش حاضر در نمونههای انفارکته، با پروتکل تمرینی فزآینده و موشهای صحرایی نر انجام شد. در توجیه اثرپذیری تمرینات ورزشی بر PTX3 میتوان گفت پنتراکسینها ازطریق واکنشهای گوناگونی در تنظیم پاسخهای التهابی شرکت میکنند. تمرین ورزشی منجر به تحریک تعامل PTX3 با پی-سلکتین میشود [31]. این تعامل در پاسخ بهمحرک التهابی، انباشت نوتروفیلها را متوقف میکند و با سازوکار بازخورد منفی، فراخوانی اولیه نوتروفیلها را کنترل میکند. بنابراین بهعنوان یک تنطیمکننده ذاتی پاسخ التهابی اولیه عمل میکند و احتمالا آسیب بافتی شدید ناشی از التهاب انفارکتوس میوکارد را کاهش میدهد [31]. همچنین PTX3 باعث افزایش فعالسازی عامل رشد تغییر شکلدهنده بتا میشود و پاسخهای ضدالتهابی در ماکروفاژها را القا میکند [32].
ازآنجاکه القای بیان PTX3 از راه مسیرPI3K/Akt تأثیر آتروپروتکتیک دارد، تعدیل مثبت PTX3 مانع از فعالشدن مسیرهای آبشار التهابی میشود و از آسیب دیواره عروق قلبی محافظت میکند [33]. بنابراین با القای انفارکتوس و افزایش PTX3 اثرات ضدالتهابی بیشتری نسبت به برخی تحقیقات دیگر دیده شده [7، 30] و انجام تمرینات ورزشی منجر به کاهش PTX3 و درنهایت کاهش التهاب بیماران قلبی میشود [34]. از دیگر نتایج مطالعه حاضر افزایش معناداری سطوح سرمی OPG موشهای صحرای القاشده با ISO بود. بررسی بیومارکر OPG پس از بازتوانی ورزشی فزآینده کاهش معناداری نسبت به گروه انفارکتوس میوکارد نشان داد. درخصوص پروتئین OPG جییون و همکاران در تحقیق خود نشان دادند تمرینات ترکیبی منجر به کاهش معنادار بیان پروتئین OPG میشود [15].
همسو با نتایج فوق اسپاندر و همکاران نیز گزارش کردند تمرینات استقامتی بر روی افرادی که حداقل یک مورد از فاکتورهای مرتبط با بیماری قلبی مانند اضافه وزن، هایپرتنشن، فشارخون، دیسلیپیدی، دیابت، سیگاری و سابقه ناراحتی را داشتند، نشان دادند گلیکوپروتئین OPG با کاهش همراه بود [14]. همچنین پژوهش کولین و همکاران در برنامه تمرینی ورزشی بر سطوح سرمی OPG افراد با اضافه وزن و چاق کاهش آن را بیان کردند [35]. در تضاد با نتایج این تحقیق گائینی و همکاران افزیش بیان ژن OPG موشهای صحرایی را بعد تمرینات ورزشی را نشان دادند [36] که با نتایج دیگر مطالعه که منجر به افزایش OPG بهدنبال تمرینات ورزشی شد، همسو بود [37]. علت تناقض ایجادشده را میتوان به سالم بودن نمونههای تحقیق، تمرینات مقاومتی و جنسیت متفاوت مطالعات فوق اشاره کرد.
سیتوکاین OPG در فعالیت التهابی، اختلال عملکرد اندوتلیال، استرس بیومکانیکی، مرگومیرهای قلبیعروقی، احتقاق قلبی و بیماری شریان کرونری دخیل میباشد [9]. این پروتئین از سلولهای متفاوتی مانند قلب و عروق، دیواره شریانها، عضلات عروق صاف و سلولهای اندتلیوم ترشح میشود [38] در اندوتلیال سلولها OPG بهواسطه تحریک TNF-α، IL1 و INF-α از گرانولها ترشح میشود. با این روش تزریق ISO منجر به افزایش مارکرهای فوق و درنهایت منجر به افزایش OPG در بیماران انفارکتوس قلبی میشود [39]. افرایش فاکتورهای التهابی منجر به تنطیم بالایی از RANKL از عضلات عروق و بهدنبال آن ترشح MMP و تخریب دیواره عروق و درنهایت ایجاد پلاک، ترمبوز و بیثبایت عملکرد قلبی میشود [40]. تمرینات ورزشی با کاهش فرایندهای التهابی و مهار مسیر بیانشده میتوانند منجر به کاهش مقادیر OPG و درنهایت بهبود علائم بالینی بیماران تحتمداخله بازتوانی ورزشی قلبی شوند [42]. بهنظر میرسد بیماری انفارکتوس میوکارد بهصورت درازمدت ثأثیرات خود را برجای میگذارد، شاید طول دوره پژوهش در تحقیق حاضر از محدودیتهای مهم برای بررسی دقیق اثرات تمرین ورزشی فزآینده بر این بیماری باشد. بنابراین توصیه میشود در مطالعات بعدی از بازه زمانی بیشتری استفاده شود.
نتیجهگیری
درمجموع یافتههای تحقیق فوق حاکی از کاهش سطوح سرمی PTX3 و OPG در گروه تمرینی را نشان میدهد. به نظر میرسد برای بهبود روند بیماران قلبی بازتوانی ورزشی فزآینده با کاهش التهاب بیماران مبتلا به انفارکتوس قلبی میتواند مزایای بالینی زیادی همراه داشته باشد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
در این پژوهش انجام تمام برنامههای تجربی بر روی حیوانات آزمایشگاهی (آشناسازی، تمرین، بیهوشی و کشتن حیوان) برحسب قوانین کمیته اخلاق و پروتکل نحوه رفتار با حیوانات انجام شد. این تحقیق با کد IR.IAU.ARAK.REC.1397.007 در کمیته اخلاق پژوهشی دانشگاه علوم پزشکی اراک تصویب شده است.
حامی مالی
این مقاله برگرفته از رساله دکتری بابک امیرسرداری، گروه تربیت بدنی، دانشکده علوم ورزشی، دانشگاه آزاد اسلامی، واحد بروجرد است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از همکاری تمامی افرادی که در تحقیق حاضر شرکت داشتند، تشکر و قدردانی میشود.
References
1.Virani SS, Alonso A, Benjamin EJ, Bittencourt MS, Callaway CW, Carson AP, et al. Heart disease and stroke statistics-2020 update: A report from the American Heart Association. Circulation. 2020; 141(9):e139-596. [DOI:10.1161/CIR.0000000000000757] [PMCID]
2.Zhao ZQ. Velez DA, Wang NP, Hewan-Lowe KO, Nakamura M, Guyton RA, et al. Progressively developed myocardial apoptotic cell death during late phase of reperfusion. Apoptosis. 2001; 6(4):279-90. [DOI:10.1023/A:1011335525219] [PMID]
3.Krishnamurthy P, Rajasingh J, Lambers E, Qin G, Losordo DW, Kishore R. IL-10 inhibits inflammation and attenuates left ventricular remodeling after myocardial infarction via activation of STAT3 and suppression of HuR. Circulation Research. 2009; 104(2):e9-18. [DOI:10.1161/CIRCRESAHA.108.188243] [PMID] [PMCID]
4.Joshi NV, Toor I, Shah AS, Carruthers K, Vesey AT, Alam SR, et al. Systemic atherosclerotic inflammation following acute myocardial infarction: Myocardial infarction begets myocardial infarction. Journal of the American Heart Association. 2015; 4(9):e001956. [DOI:10.1161/JAHA.115.001956] [PMID] [PMCID]
5.Rolph MS, Zimmer S, Bottazzi B, Garlanda C, Mantovani A, Hansson GK. Production of the long pentraxin PTX3 in advanced atherosclerotic plaques. Arteriosclerosis, Thrombosis, and Vascular Biology. 2002; 22(5):e10-4. [DOI:10.1161/01.ATV.0000015595.95497.2F] [PMID]
6.Yang HS, Woo JE, Lee SJ, Park SH, Woo JM. Elevated plasma pentraxin 3 levels are associated with development and progression of diabetic retinopathy in Korean patients with type 2 diabetes mellitus. Investigative Ophthalmology & Visual Science. 2014; 55(9):5989-97.[DOI:10.1167/iovs.14-14864] [PMID]
7.Miyaki A, Maeda S, Choi Y, Akazawa N, Tanabe Y, Ajisaka R. Habitual aerobic exercise increases plasma pentraxin 3 levels in middle-aged and elderly women. Applied Physiology, Nutrition, and Metabolism. 2012; 37(5):907-11. [DOI:10.1139/h2012-069] [PMID]
8.Collin-Osdoby P. Regulation of vascular calcification by osteoclast regulatory factors RANKL and osteoprotegerin. Circulation Research. 2004; 95(11):1046-57. [DOI:10.1161/01.RES.0000149165.99974.12] [PMID]
9.Caidahl K, Ueland T, Aukrust P. Osteoprotegerin: A biomarker with many faces. Arteriosclerosis, Thrombosis, and Vascular Biology. 2010; 30(9):1684-6. [DOI:10.1161/ATVBAHA.110.208843] [PMID]
10.Kruzliak P, Berezin A, Kremzer A, Samura T, Benacka R, Mozos I, et al. Global longitudinal strain and strain rate in type two diabetes patients with chronic heart failure: Relevance to osteoprotegerin. Folia Medica. 2016; 58(3):164-73. [DOI:10.1515/folmed-2016-0021] [PMID]
11.Lawler PR, Filion KB, Eisenberg MJ. Efficacy of exercise-based cardiac rehabilitation post–myocardial infarction: A systematic review and meta-analysis of randomized controlled trials. American Heart Journal. 2011; 162(4):571-84. [DOI:10.1016/j.ahj.2011.07.017] [PMID]
12.Fukuda T, Kurano M, Iida H, Takano H, Tanaka T, Yamamoto Y, et al. Cardiac rehabilitation decreases plasma pentraxin 3 in patients with cardiovascular diseases. European Journal of Preventive Cardiology. 2012; 19(6):1393-400. [DOI:10.1177/1741826711422990] [PMID]
13.Basati F, Siahkoohian M, Golabchi A, Moshtaghi M. [Effects of 8 weeks aerobic exercise training on plasma levels of pentraxin3 and C-reactive protein in diabetic and non-diabetic coronary artery disease patients after revascularization interventions (Persian)]. Sport Physiology. 2018; 10(38):163-80. [doi:10.22089/spj.2018.4161.1562]
14.Sponder M, Campean IA, Emich M, Fritzer-Szekeres M, Litschauer B, Bergler-Klein J, et al. Endurance training significantly increases serum endocan but not osteoprotegerin levels: a prospective observational study. BMC Cardiovascular Disorders. 2017; 17(1):13.[DOI:10.1186/s12872-016-0452-7] [PMID] [PMCID]
15.Kim JY, Kim HJ, Kim CS. Effects of 12-week combined exercise on RANKL/RANK/OPG signaling and bone-resorption cytokines in healthy college females. Journal of Exercise Nutrition & Biochemistry. 2019; 23(1):13-20. [DOI:10.20463/jenb.2019.0003] [PMID] [PMCID]
16.Bertinchant JP, Robert E, Polge A, Marty-Double C, Fabbro-Peray P, Poirey S, et al. Comparison of the diagnostic value of cardiac troponin I and T determinations for detecting early myocardial damage and the relationship with histological findings after isoprenaline-induced cardiac injury in rats. Clinica Chimica Acta. 2000; 298(1-2):13-28.[DOI:10.1016/S0009-8981(00)00223-0] [PMID]
17.Lobo Filho HG, Ferreira NL, Sousa RB, Carvalho ER, Lobo PL, Lobo Filho JG. Modelo experimental de infarto do miocárdio induzido por isoproterenol em ratos. Brazilian Journal of Cardiovascular Surgery. 2011; 26(3):469-76. [DOI:10.5935/1678-9741.20110024] [PMID]
18.MalekiPoya M, Palizvan MR, Saremi A. [The effect of eight weeks of incremental endurance training on the levels of matrix metalloproteinase-1 (MMP1) and thrombosponidine-1 (TSP1) in the rats, induced by myocardial infarction by isoproterenol (Persian)]. Journal of Arak University of Medical Sciences. 2019; 22(3):118-28. [Link]
19.Afzalpoura ME, Yousefib MR, Eivaric SH, Ilbeigid S. Changes in blood insulin resistance, GLUT4 & AMPK after continuous and interval aerobic training in normal and diabetic rats. Journal of Applied Pharmaceutical Science. 2016; 6(9):076-81. [DOI:10.7324/JAPS.2016.60911]
20.Prabhu SD, Frangogiannis NG. The biological basis for cardiac repair after myocardial infarction: From inflammation to fibrosis. Circulation Research. 2016; 119(1):91-112. [DOI:10.1161/CIRCRESAHA.116.303577] [PMID] [PMCID]
21.Newby LK. Inflammation as a treatment target after acute myocardial infarction. The New England Journal of Medicine. 2019; 381(26):2562-3. [DOI:10.1056/NEJMe1914378] [PMID]
22.Pokorný J, Staněk V, Vrána M. Sudden cardiac death thirty years ago and at present. The role of autonomic disturbances in acute myocardial infarction revisited. Physiological Research. 2011; 60(5):715-28. [DOI:10.33549/physiolres.932110] [PMID]
23.López-Mejías R, Castañeda S, González-Juanatey C, Corrales A, Ferraz-Amaro I, Genre F, et al. Cardiovascular risk assessment in patients with rheumatoid arthritis: The relevance of clinical, genetic and serological markers. Autoimmunity Reviews. 2016; 15(11):1013-30. [DOI:10.1016/j.autrev.2016.07.026] [PMID]
24.Ruberti OM, Sousa AS, Viana LR, Pereira Gomes MF, Medeiros A, Gomes Marcondes MC, et al. Aerobic training prevents cardiometabolic changes triggered by myocardial infarction in ovariectomized rats. Journal of Cellular Physiology. 2021; 236(2):1105-15. [DOI:10.1002/jcp.29919] [PMID]
25.Upaganlawar A, Gandhi C, Balaraman R. Effect of green tea and vitamin E combination in isoproterenol induced myocardial infarction in rats. Plant Foods for Human Nutrition. 2009; 64(1):75-80. [DOI:10.1007/s11130-008-0105-9] [PMID]
26.Amirsardari B, Saremi A, Maleki Pouya M. [Early exercise training attenuates cystatin C and carbohydrate antigen 125 levels after myocardial infarction in rats (Persian)]. Journal of Cell and Tissue. 2021; 12(1). [DOI:10.52547/JCT.12.1.1]
27.Ranjbar K, Nazem F, Nazari A, Golami Mr. [Effect of 10 weeks aerobic exercise training on left ventricular systolic function, Caspase-3 level and infarction size in myocardial infarction rat (Persian)]. Journal of Knowledge & Health. 2015; 10(3):16-24. [Link]
28.Azamian jazi A, Haffezi MR, Cheraghi J, Abdi H. [The combined effect of endurance training and atorvastatin on the extent of necrosis damageand fibrosis tissue in male wistar rats heart after experimental myocardial infarction (Persian)]. Journal of Ilam University of Medical Sciences. 2016; 23(7):28-38. [Link]
29.Tunc-Ata M, Turgut G, Mergen-Dalyanoglu M, Turgut S. Examination of levels pentraxin-3, interleukin-6, and C-reactive protein in rat model acute and chronic exercise. Journal of Exercise Rehabilitation. 2017; 13(3):279-83. [DOI:10.12965/jer.1734920.490] [PMID] [PMCID]
30.Nakajima T, Kurano M, Hasegawa T, Takano H, Iida H, Yasuda T, et al. Pentraxin3 and high-sensitive C-reactive protein are independent inflammatory markers released during high-intensity exercise. European Journal of Applied Physiology. 2010; 110(5):905-13. [DOI:10.1007/s00421-010-1572-x] [PMID]
31.Bottazzi B, Inforzato A, Messa M, Barbagallo M, Magrini E, Garlanda C, et al. The pentraxins PTX3 and SAP in innate immunity, regulation of inflammation and tissue remodelling. Journal of Hepatology. 2016; 64(6):1416-27.[DOI:10.1016/j.jhep.2016.02.029] [PMID] [PMCID]
32.Shiraki A, Kotooka N, Komoda H, Hirase T, Oyama JI, Node K. Pentraxin-3 regulates the inflammatory activity of macrophages. Biochemistry and Biophysics Reports. 2016; 5:290-5. [DOI:10.1016/j.bbrep.2016.01.009] [PMID] [PMCID]
33.Fornai F, Carrizzo A, Forte M, Ambrosio M, Damato A, Ferrucci M, et al. The inflammatory protein Pentraxin 3 in cardiovascular disease. Immunity & Ageing. 2016; 13(1):25. [DOI:10.1186/s12979-016-0080-1] [PMID] [PMCID]
34.Zempo-Miyaki A, Fujie S, Sato K, Hasegawa N, Sanada K, Maeda S, et al. Elevated pentraxin 3 level at the early stage of exercise training is associated with reduction of arterial stiffness in middle-aged and older adults. Journal of Human Hypertension. 2016; 30(9):521-6. [DOI:10.1038/jhh.2015.105] [PMID]
35.Davenport C, Kenny H, Ashley DT, O’Sullivan EP, Smith D, O’Gorman DJ. The effect of exercise on osteoprotegerin and TNF-related apoptosis-inducing ligand in obese patients. European journal of Clinical Investigation. 2012; 42(11):1173-9. [DOI:10.1111/j.1365-2362.2012.02703.x] [PMID]
36.Gaeini A, Eslaminejad MB, Choobineh S, Mousavi N, Satarifard S, Shafieineek L. Effects of exercise prior or during pregnancy in high fat diet fed mice alter bone gene expression of female offspring: An experimental study. International Journal of Reproductive BioMedicine. 2017; 15(2):93-100. [PMID]
37.Farzanegi P, Niak KE, Habibian M. [The effect of circuit resistance training with Medicago sativa extracts on levels of osteoprotegerin and nuclear factor of Kappa-B in thin girls (Persian)]. Pars Journal of Medical Sciences. 2016; 14(3):27-34. [DOI:10.29252/jmj.14.3.27]
38.Fuernau G, Poenisch C, Eitel I, de Waha S, Desch S, Schuler G, et al. Growth-differentiation factor 15 and osteoprotegerin in acute myocardial infarction complicated by cardiogenic shock: A biomarker substudy of the IABP-SHOCK II-trial. European Journal of Heart Failure. 2014; 16(8):880-7. [DOI:10.1002/ejhf.117] [PMID]
39.Bernardi S, Bossi F, Toffoli B, Fabris B. Roles and clinical applications of OPG and TRAIL as biomarkers in cardiovascular disease. BioMed Research International. 2016; 2016:1752854. [DOI:10.1155/2016/1752854] [PMID] [PMCID]
40.Sandberg WJ, Yndestad A, Øie E, Smith C, Ueland T, Ovchinnikova O, et al. Enhanced T-cell expression of RANK ligand in acute coronary syndrome: Possible role in plaque destabilization. Arteriosclerosis, Thrombosis, and vascular Biology. 2006; 26(4):857-63. [DOI:10.1161/01.ATV.0000204334.48195.6a][PMID] [PMID]
41.Calegari L, Nunes RB, Mozzaquattro BB, Rossato DD, Dal Lago P. Exercise training improves the IL-10/TNF-α cytokine balance in the gastrocnemius of rats with heart failure. Brazilian Journal of Physical Therapy. 2018; 22(2):154-60. [DOI:10.1016/j.bjpt.2017.09.004] [PMID] [PMCID]
42.Puhl SL, Müller A, Wagner M, Devaux Y, Böhm M, Wagner DR, et al. Exercise attenuates inflammation and limits scar thinning after myocardial infarction in mice. American Journal of Physiology. Heart and Circulatory Physiology. 2015; 309(2):H345-59. [DOI:10.1152/ajpheart.00683.2014] [PMID]
نوع مطالعه: پژوهشی |
موضوع مقاله:
علوم پايه پزشكي
دریافت: 1400/12/4 | پذیرش: 1401/4/1 | انتشار: 1401/4/10
دریافت: 1400/12/4 | پذیرش: 1401/4/1 | انتشار: 1401/4/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





