دوره 28، شماره 3 - ( تابستان 1401 )
جلد 28 شماره 3 صفحات 397-382 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Soheilian‑Khorzoghi M, Rostami‑Nejad M, Haddadi A, Yadegar A, Dabiri H. Comparison of the Lactobacillus and Bifidobacterium Population in Fecal Microbiome of Celiac Disease Patients on Gluten-Free Diet With Healthy Subjects. Intern Med Today 2022; 28 (3) :382-397
URL: http://imtj.gmu.ac.ir/article-1-3842-fa.html
URL: http://imtj.gmu.ac.ir/article-1-3842-fa.html
سهیلیان خورذوقی مونا، رستمی نژاد محمد، حدادی اعظم، یادگار عباس، دبیری حسین. مقایسه جمعیت لاکتوباسیلوس و بیفیدوباکتریوم در میکروبیوم مدفوعی افراد مبتلا به بیماری سلیاک تحت رژیم غذایی فاقد گلوتن با افراد سالم. طب داخلی روز. 1401; 28 (3) :382-397
مونا سهیلیان خورذوقی1 

 ، محمد رستمی نژاد2
، محمد رستمی نژاد2 

 ، اعظم حدادی1
، اعظم حدادی1 

 ، عباس یادگار3
، عباس یادگار3 

 ، حسین دبیری*
، حسین دبیری* 

 4
4


 ، محمد رستمی نژاد2
، محمد رستمی نژاد2 

 ، اعظم حدادی1
، اعظم حدادی1 

 ، عباس یادگار3
، عباس یادگار3 

 ، حسین دبیری*
، حسین دبیری* 

 4
4
1- گروه میکروبیولوژی، واحد کرج، دانشگاه آزاد اسلامی، کرج، ایران.
2- مرکز تحقیقات بیماریهای گوارش و کبد، پژوهشکده بیماریهای گوارش و کبد، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران.
3- مرکز تحقیقات بیماریهای منتقله از آب و غذا، پژوهشکده بیماریهای گوارش و کبد، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران.
4- گروه میکروبشناسی، دانشکده علوم پزشکی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران. ، hdabiri@sbmu.ac.ir
2- مرکز تحقیقات بیماریهای گوارش و کبد، پژوهشکده بیماریهای گوارش و کبد، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران.
3- مرکز تحقیقات بیماریهای منتقله از آب و غذا، پژوهشکده بیماریهای گوارش و کبد، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران.
4- گروه میکروبشناسی، دانشکده علوم پزشکی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران. ، hdabiri@sbmu.ac.ir
متن کامل [PDF 4896 kb]
(391 دریافت)
| چکیده (HTML) (603 مشاهده)
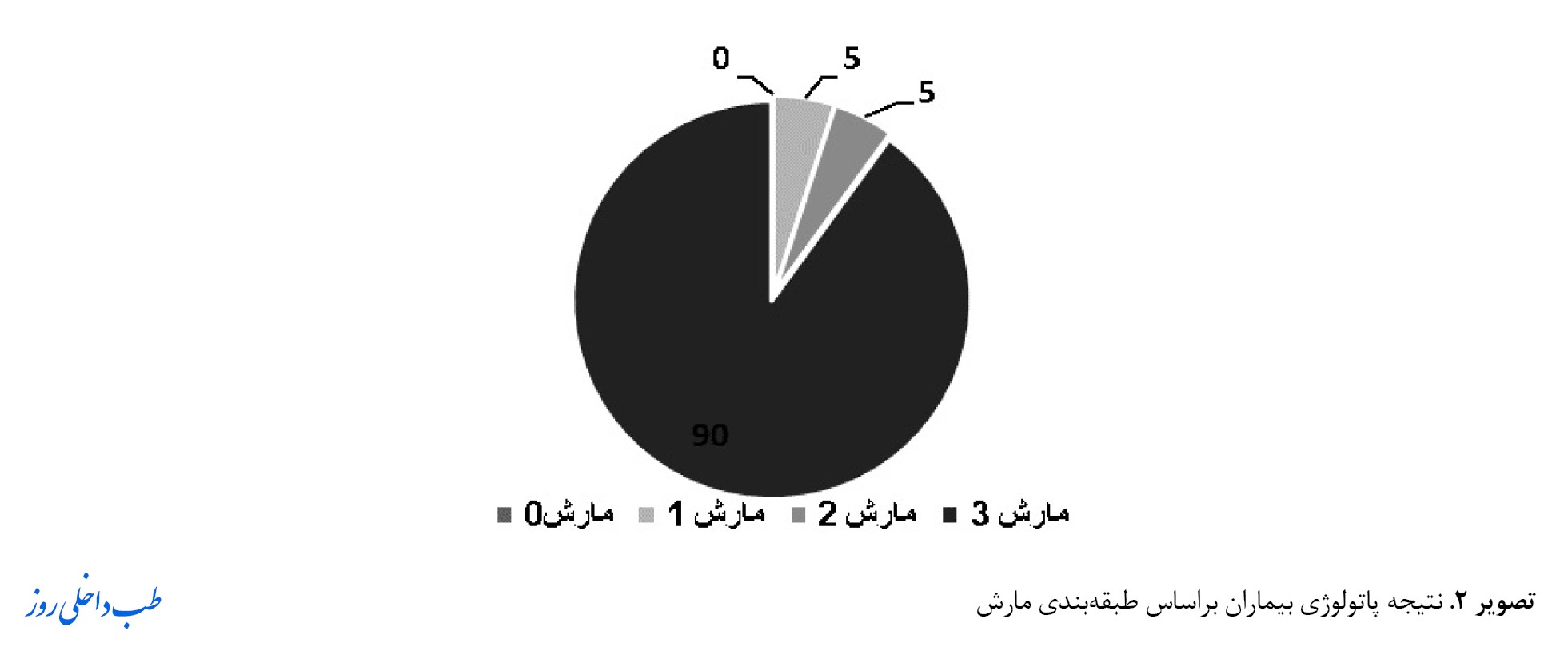
همانطورکه در تصویر شماره 2 نشان داده شده است ازنظر نتایج پاتولوژی اکثر افراد مبتلا به بیماری سلیاک در گروه مارش 3 (18نفر) قرار گرفتند.
نتایج مطالعه نشان داد که 2 گروه آزمایش و کنترل ازنظر طبقهبندی مارش اختلاف معناداری وجود ندارد جدول شماره 1 نشان داده شده است.

نتایج حاصل از این مطالعه نشان میدهد که سیکل آستانه میزان باکتریهای بیفیدوباکتریوم و لاکتوباسیلوس در افراد مبتلا به سلیاک در مقایسه با گروه سالم بهطور معناداری بالاتر میباشد (0/05>P). ازآنجاییکه سیکل آستانه با میزان شمارش نسبت عکس دارد، میزان شمارش این 2 باکتری مفید مورد بررسی در بیماران سلیاکی در مقایسه با افراد سالم بهطور معناداری کمتر میباشد (0/05>P).
بحث
شواهد اخیر در رابطه با بیماری سلیاک نشان داده است که ایمنی ذاتی در تحریک پاسخ ایمنی ازطریق تحریک پاسخ ایمنی اکتسابی و آسیب مخاطی نقش بسیار مهمی دارد. اتصال میکروبیوتای رودهای با دیواره مخاط روده ازطریق همان گیرندههایی انجام میشود که ایمنی ذاتی را میتوانند فعال کنند. بنابراین، تغییر در میکروبیوتای روده ممکن است به فعال شدن این مسیر التهابی منجر شود [17]. درواقع، گونههای مفید میکروبیوتای روده در بیماران مبتلا به بیماری سلیاک کاهش یافته و از طرفی گونههای بیماریزا بهطور بالقوه نسبت به افراد سالم افزایش پیدا میکنند. در این بیماران اگرچه بعد از رژیم غذایی فاقد گلوتن، ناترازی در میکروبیوتای رودهای کاهش مییابد، اما بهطورکامل از بین نمیرود. بنابراین، میکروبیوتای رودهای نقش حائز اهمیتی را در پاتوژنز یا بیماریزایی بیماری سلیاک دارد [18, 19, 20].
ازطرفی مطالعات کمتری تعداد و ترکیب میکروبیوتای رودهای و نقش آن در پاتوژنز بیماری سلیاک و همچنین مقایسه ترکیب میکروبیوتای رودهای در افراد مبتلا به بیماری سلیاک درمقایسه با افراد فاقد این بیماری را مورد بررسی قرار دادهاند. بنابراین در مطالعه حاضر ترکیب میکروبیوتای رودهای مشخص ازجمله بیفیدوباکتریوم و لاکتوباسیلوس در بیماران مبتلا به سلیاک در مقایسه با افراد سالم مورد بررسی قرار گرفته است و نشان داده شد که جمعیت میکروبیوتای رودهای در بیماران سلیاکی، تفاوتهای معناداری را در مقایسه با افراد سالم دارند؛ بدینگونه که افراد بیمار میزان کمتری از باکتریهای رودهای مفید بیفیدوباکتریوم و لاکتوباسیلوس را نسبت به افراد سالم دارند. بررسی تنوع میکروبیوتای رودهای در افراد مبتلا به بیماری سلیاک در مقایسه با افراد سالم در مطالعات گوناگونی انجام شده است که نتایج حاصل از مطالعه حاضر را نیز تأیید میکنند [10، 21].
گلفتو و همکاران نظر موافقی با نتایج حاصل از مطالعه حاضر در جهت پایین بودن میزان بیفیدوباکتریوم و ناترازی در میکروبیوتای رودهای در بیماران مبتلا به بیماری سلیاک حتی با وجود رعایت رژیم غذایی فاقد گلوتن ارائه کردند که این واقعیت حمایتکننده روند پاتولوژیک بیماری سلیاک میباشد [22]. مشابه پژوهش حاضر، مطالعه مورایس و همکاران میباشد که تفاوت در پروفایل میکروبی بین کودکان مبتلا به بیماری سلیاک و گروه کنترل را گزارش کردند و نشان دادند که بیماران سلیاکی میزان کمتری از لاکتوباسیل و بیفیدوباکتریوم را در مقایسه با افراد سالم دارند. بررسیها نشان دادهاند که بیفیدوباکتریوم و لاکتوباسیلوس که جزء پروبیوتیکها نیز میباشند، میتوانند در هضم یا تغییر پلیپپتیدهای گلوتن نقش داشته باشند. ازطرفی برخی از گونههای باکتریایی متعلق به جنس لاکتوباسیلوس و بیفیدوباکتریوم نقش حفاظتی بر روی سلولهای اپیتلیال در برابر آسیبهای ناشی از گلیادین دارند [23].
کولادو و همکاران در مطالعهای مشابه با مطالعه حاضر با هدف شناسایی باکتریهای روده اختصاصی مرتبط با بیماری سلیاک در تشخیص و پس از درمان با رژیم فاقد گلوتن، نمونه مدفوع کودکان مبتلا به سلیاک درماننشده و تحترژیم فاقد گلوتن، نمونه بیوپسی بیماران مبتلا به سلیاک درماننشده و تحترژیم فاقد گلوتن و نمونه مدفوع و بیوپسی کودکان سالم بهعنوان گروه کنترل را برای مقایسه بین 2 گروه مورد بررسی قرار دادند و از روش ریل تایم پیسیآر برای اندازهگیری باکتریهای روده استفاده کردند. نتایج حاصل از این مطالعه تفاوت بین تعداد برخی از میکروبیوتای رودهای مانند باکتریوئیدس و کلستریدیوم لپتوم را بین کودکان مبتلا به سلیاک نسبت به گروه کنترل صرفنظر از مرحله بیماری و همچنین تفاوت در تعداد کولای و استافیلوکوکوس را درکودکان مبتلا به سلیاک درماننشده در مقایسه با گروه کنترل نشان دادند. همچنین در این مطالعه، میزان کمتری از بیفیدوباکتریوم در مدفوع هر 2 گروه از بیماران و بیوپسی افراد درماننشده در مقایسه با گروه کنترل نیز گزارش شد [10].
در مطالعه مشابه دیگری که توسط سانز و همکاران انجام شد، میزان شمارش میکروبیوتای مدفوعی در جمعیت کودکان مبتلا به بیماری سلیاک نسبت به کنترلهای همسان با سن توسط تکنیک زنجیرهای پلیمراز و الکتروفورز ژل گرادیان دناتوره مورد تجزیهوتحلیل قرار گرفت و افزایش معناداری را در جمعیت میکروبیوتای مدفوع در بیماران مبتلا به سلیاک نسبت به افراد سالم گزارش کردند. از طرفی در بیماران مبتلا به سلیاک حضور اختصاصی گونههای لاکتوباسیلوس کورواتوس و در گروه سالم حضور لاکتوباسیلوس کازئی بهعنوان گونه باکتری مشخصه این گروه را نیز مشاهده کردند. همچنین میزان شمارش گونه بیفیدو باکتریوم بهطور قابلتوجهی در گروه دارای سلیاک نسبت به گروه سالم کمتر بود [22].
نیستال و همکاران مطالعهای مشابه با مطالعه حاضر با هدف بررسی تفاوت در میکروبیوتای روده در بزرگسالان مبتلا به سلیاک و افراد سالم انجام دادند و توسط تکنیکهای الکتروفورز ژنتیکی شیب و کروماتوگرافی مایع گازی از اسیدهای چرب زنجیره کوتاه، جوامع میکروبی را در نمونههای مدفوع بیماران مبتلا به سلیاک درماننشده، بیماران سلیاکی تحتدرمان با رژیم فاقد گلوتن و جمعیت سالم سنجیدند و کاهش در تنوع گونههای لاکتوباسیلوس و بیفیدوباکتریوم را در بیماران سلیاکی تحت درمان، مشاهده کردند. همچنین گروه سلیاکی تحتدرمان نسبت به بزرگسالان سالم بهطور معناداری میزان بیشتری از حضور بیفیدوباکتریوم بیفیدوم را نشان داد. نتایج کلی حاصل از این مطالعه تفاوت در میکروبیوتای مدفوعی بیماران سلیاکی درماننشده نسبت به افراد سالم را نشان داد. نیستال و همکاران نیز با نظر موافقی با مطالعه حاضر نشان دادند که رژیم غذایی فاقد گلوتن در بیماران سلیاکی اگرچه تا حدی میکروبیوتای گوارشی را در این بیماران به حالت طبیعی برمیگرداند، اما باوجوداین در این بیماران تنوع لاکتوباسیلوس و بیفیدوباکتریوم به میزان قابلتوجهی کاهش مییابد [24].
در مطالعه مشابه دیگری که در سال 2020 توسط نایلوند و همکاران بر روی بیماران مبتلا به سلیاک و افراد حساس به گلوتن فاقد سلیاک تحت رژیم غذایی فاقد گلوتن و افراد سالم مصرفکننده جوی دوسر انجام شد، ترکیب میکروبیوتای مدفوعی در گروههای مورد مطالعه بررسی شد و نتایج حاصل نشان داد که اگرچه در بزرگسالان سالم فراوانی بیفیدوباکتریوم در مقایسه با بیماران سلیاکی و گروه حساس به گلوتن فاقد سلیاک به سمت بالاتری گرایش داشت، اما اختلاف معناداری ازنظر گوناگونی در ترکیب میکروبی در گروههای مورد مطالعه نشان نداد [25].
در مطالعه دی بیاس و همکاران ترکیب میکروبیوتای گوارشی را در نمونههای مدفوع و 12 کودکان مبتلا به سلیاک در شروع بیماری با گروه سالم مقایسه کردند. نتایج کلی حاصل از این مطالعه نیز مشابه با مطالعه حاضر تفاوت در میکروبیوتای گوارشی در کودکان مبتلا به سلیاک را در شروع بیماری در مقایسه با گروه سالم نشان داد. کاهش در فراوانی باکتریهای مفیدی مانند باکتروئیدس/پریووتلا و آکرمانسیا در نمونه مدفوع بیماران مبتلا به سلیاک در مقایسه با گروه سالم نیز مشاهده شد [26]. علاوهبراین، برخی مطالعات دیگر نیز نتایج مطالعه حاضر را تأیید کردند و ثابت میکند که 2 باکتری مفید بیفیدوباکتریوم و لاکتوباسیلوس میتوانند در بیماران مبتلا به بیماری سلیاک نقش محافظتی را در برابر پاسخ التهابی و آسیب مخاطی ناشی از پپتیدهای گلیادین داشته باشند. همچنین نقشهای درمانی این پروبیوتیکها را نیز توضیح میدهند [19, 20, 21, 22, 23, 24, 25]. کاهش میزان باکتریهای مفید مانند لاکتوباسیلوس و بیفیدوباکتریوم در بیماران دارای سلیاک منجر به افزایش پاتوژنهای فرصتطلب در بیماران دارای سلیاک و درنهایت منجر به نقص سیتم ایمنی این بیماران میشود [27].
براساس مطالعات پیشین، میکروبیوتای رودهای در بیماران مبتلا به بیماری سلیاک با وجود رعایت رژیم غذایی فاقد گلوتن بهطور کامل ترمیم نمیشود [10] و میزان برخی از باکتریهای مفید گوارشی مانند بیفیدوباکتریوم در افراد دارای سلیاک با وجود این نوع رژیم باز هم نسبت به افراد سالم بهطور معناداری کمتر میباشد. اگرچه نتایج حاصل از اکثریت مطالعات صورتگرفته درزمینه بررسی تنوع میکروبیوتای رودهای بیماران دارای سلیاک تحت رژیم فاقد گلوتن و مقایسه آن با افراد سالم در سرتاسر جهان، تنوع و شمارش متفاوت میکروبیوتای رودهای این بیماران با افراد سالم را نشان میدهند [28]. این نتایج همگی مؤید نتایج بررسی کنونی میباشد. در بررسی کنونی جامعه هدف بیماران و افراد سالم میانسال در جامعه شهری و با رژیم غذایی میانه و معمول بودهاند. این افراد در بررسی و در مقایسه با گروه افراد سالم دارای ناترازی در میزان پروبیوتیکهای طبیعی فلور بودهاند. میزان لاکتوباسیلوس و بیفیدیدیوباکتریوم دفعشده در این افراد کمتر از گروه سالم میباشد که بازتابی از وضعیت فلور رودهای این افراد است که ناشی از وضعیت ناتراز فلور میکربی و فقر باکتریهای پروبیوتیک در سیستم گوارشی این افراد میباشد. درمقابل، مطالعاتی هم بودند که هیچ تفاوتی را بین میکروبیوتای رودهای بیماران دارای سلیاک تحترژیم فاقد گلوتن و گروه کنترل نشان نداند و اعلام کردند که به نظر میرسد میکروبیوتای رودهای نقشی در پاتوژنز بیماری سلیاک ندارد [29]. از طرفی داشتن این نوع رژیم غذایی در این بیماران، براساس نتایج مطالعات پیشین تنها منجر به بهبود بخشی از میکروبیوتای رودهای میشود [30] که دلایل آن نیز بهطور قطعی مشخص نمیباشد، اما عواملی مانند ژنتیک بیمار مبتلا به سلیاک با وجود رژیم غذایی فاقد گلوتن به احتمال زیاد میتواند بر ترکیب میکروبیوتای روده اثرگذار باشد [31]. از طرفی گلوتن دارای یک عملکرد پربیوتیک مانند است که حذف این پروتئین از رژیم فاقد گلوتن نیز میتواند در ایجاد یک میکروبیوتای روده متفاوت در این بیماران در مقایسه با افراد سالم شود [32]. بنابراین، درمجموع میتوان بیان کرد که با اصلاح سیستم تغذیهای با رویکرد تقویت سیستم پروبیوتیک سیستم گوارشی و تنظیم پایایی و زیستایی آنها بتوان عوارض بیماری سلیاک را که به نوعی نقص در سیستم ژنی با محرکهای اپی ژنیک است، تعدیل کرد.
ازنظر فیزیولوژیک باتوجهبه آتروفی پرزهای رودهای در این بیماری، شاید نقص در حفظ تراز فلور میکربی طبیعی را بتوان علاوهبر آنکه از عوارض ناشی از این بیماری دانست، در رویکردی دیگر خود این عامل را مسبب تشدید این بیماری قلمداد کرد. باتوجهبه سایر عوامل محیطی و زیستی مؤثر این سلسله از عوامل را بروز شرایط فقر تغذیهای و نقص در سطوح طبیعی ریزمغذیها دانست [16، 33، 34]. عوامل در مطالعه حاضر، میکروبیوتای رودهای و کاهش در میزان باکتریهای مفید بیفیدوباکتریوم و لاکتوباسیلوس بین 2 گروه مورد مطالعه متفاوت و در گروه دارای عارضه سلیاک کاهش یافته است. باتوجهبه حجم نمونه گزارششده، با قاطعیت نمیتوان این تفاوت بین میکروبیوتای رودهای افراد مبتلا به سلیاک و سالم را گزارش کرد و نیاز به انجام مطالعه در حجم نمونههای بزرگتر میباشد.
همانگونه که در بخش یافتهها نشان داده شد، نتایج حاصل از 2 آزمون کایاسکوئر پیرسون برای متغیرهای دستهای و آزمون تی برای متغیرهای عددی که بهمنظور تعیین یکپارچگی بین 2 گروه آزمایش و کنترل در تجزیهوتحلیل آماری دادههای جمعیتشناختی انجام شد، نشان داد که 2 گروه مورد مطالعه ازنظر دادههای جمعیتشناختی با هم اختلاف معناداری ندارند. این مسئله نقطه قوت مطالعه حاضر میباشد؛ زیرا این نتایج یکپارچگی بین 2 گروه مورد مطالعه را تأیید و 2 گروه را بهراحتی قابل مقایسه و بررسی کرده است.
مطالعه حاضر دارای محدودیتهایی بود. اولاً، این مطالعه در حجم نمونه کمی و در یک مرکز واحد در تهران، ایران انجام شده است.
محدودیت دیگر مطالعه حاضر مدتزمان محدود مطالعه و انتخاب بیمار بود.
نتیجهگیری
مطالعه حاضر همسو با سایر مطالعات، پدیده ناترازشدن میکروبیوتای روده در بیماران مبتلا به سلیاک نسبت به افراد سالم را نشان میدهد. درنتیجه میتوان گفت، بررسی میکروبیوتای مدفوع میتواند نشانگر خوبی از پدیده ناترازشدن میکروبیوتای روده در بیماران مبتلا به سلیاک باشد و میتواند برای نظارت بر ترمیم میکروبیوتا در طی رژیم فاقد گلوتن مورداستفاده قرار گیرد؛ بهطوریکه دادههای مربوط به متابولیک همراه با ارزیابی میکروبیوتای روده بیماران میتواند به پزشکان در ارزیابی نقش میکروبیوتای رودهای در روند بیماریزایی یا پاتوژنزیس بیماری سلیاک و همچنین بررسیهای بیشتر کمک کند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
پیروی از اصول اخلاق پژوهش پژوهشگران همه کدهای اخلاقی مربوط به تحقیقات بر روی نمونههای انسانی رعایت شده و مجوزهای لازم را از مراجع صاحب صلاحیت دریافت شده است. این مطالعه با کد اخلاق IR.SBMU.RIGLD.REC.1395.114 کمیته اخلاق مرکز تحقیقات بیماریهای گوارش و کبد دانشگاه علوم پزشکی و خدمات درمانی شهید بهشتی و با کد ثبت IRCT20171225038063N1 مرکز ثبت کارآزمایی بالینی ایران (IRCT) به تصویب رسید.
حامی مالی
این تحقیق با حمایت مالی مرکز تحقیقات بیماریهای گوارش و کبد دانشگاه علوم پزشکی و خدمات درمانی شهید بهشتی انجام شده است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتند.تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان این مقاله از معاونت پژوهشی و همکاران پژوهشکده بیماریهای گوارش و کبد دانشگاه علوم پزشکی و خدمات درمانی شهید بهشتی و مسئولین محترم دانشگاه آزاد اسلامی واحد کرج به دلیل حمایتهای بیدریغشان تشکر و قدردانی میشود.
References
1.Nadal I, Donant E, Ribes-Koninckx C, Calabuig M, Sanz Y. Imbalance in the composition of the duodenal microbiota of children with coeliac disease. Journal of Medical Microbiology. 2007; 56(Pt 12):1669-74. [DOI:10.1099/jmm.0.47410-0] [PMID]
2.Di Sabatino A, Corazza GR. Coeliac disease. Lancet. 2009; 373(9673):1480-93. [DOI:10.1016/S0140-6736(09)60254-3] [PMID]
3.Kaukinen K, Lindfors K, Collin P, Koskinen O, Mäki M. Coeliac disease-a diagnostic and therapeutic challenge. Clinical Chemistry and Laboratory Medicine. 2010; 48(9):1205-16. [DOI:10.1515/cclm.2010.241] [PMID]
4.Catassi C, Kryszak D, Bhatti B, Sturgeon C, Helzlsouer K, Clipp SL, et al. Natural history of celiac disease autoimmunity in a USA cohort followed since 1974. Annals of Medicine. 2010; 42(7):530-8. [DOI:10.3109/07853890.2010.514285] [PMID]
5.Sanz Y, De Pama G, Laparra M. Unraveling the ties between celiac disease and intestinal microbiota. International Reviews of Immunology. 2011; 30(4):207-18. [DOI:10.3109/08830185.2011.599084] [PMID]
6.Ghosh S. Advances in our understanding of the pathogenesis of celiac disease. Canadian Journal of Gastroenterology . 2011; 25(4):186. [DOI:10.1155/2011/684230] [PMID] [PMCID]
7.Guarner F, Malagelada JR. Gut flora in health and disease. Lancet. 2003; 361(9356):512-9. [DOI:10.1016/S0140-6736(03)12489-0] [PMID]
8.Cristofori F, Indrio F, Miniello VL, De Angelis M, Francavilla R. Probiotics in celiac disease. Nutrients. 2018; 10(12):1824. [DOI:10.3390/nu10121824] [PMID] [PMCID]
9.Nakayama J, Kobayashi T, Tanaka S, Korenori Y, Tateyama A, Sakamoto N, et al. Aberrant structures of fecal bacterial community in allergic infants profiled by 16S rRNA gene pyrosequencing. FEMS Immunology and Medical Microbiology. 2011; 63(3):397-406. [DOI:10.1111/j.1574-695X.2011.00872.x] [PMID]
10.Collado MC, Donat E, Ribes-Koninckx C, Calabuig M, Sanz Y. Specific duodenal and faecal bacterial groups associated with paediatric coeliac disease. Journal of Clinical Pathology. 2009; 62(3):264-9. [DOI:10.1136/jcp.2008.061366] [PMID]
11.Davis CD, Milner JA. Gastrointestinal microflora, food components and colon cancer prevention. The Journal of Nutritional Biochemistry. 2009; 20(10):743-52. [DOI:10.1016/j.jnutbio.2009.06.001] [PMID] [PMCID]
12.Ou G, Hedberg M, Horstedt P, Baranov V, Forsberg G, Drobni M,et al. Proximal small intestinal microbiota and identification of rod-shaped bacteria associated with childhood celiac disease. The American Journal of Gastroenterology. 2009; 104(12):3058-67. [DOI:10.1038/ajg.2009.524] [PMID]
13.Sanders ME. Impact of probiotics on colonizing microbiota of the gut. Journal of Clinical Gastroenterology. 2011; 45(S):S115-9. [DOI:10.1097/MCG.0b013e318227414a] [PMID]
14.Marsh MN, Johnson MW, Rostami K. Mucosal histopathology in celiac disease: A rebuttal of Oberhuber’s sub-division of Marsh III. Gastroenterology and Hepatology from Bed to Bench. 2015; 8(2):99-109. [PMID]
15.Chen H, Rangasamy M, Tan SY, Wang H, Siegfried BD. Evaluation of five methods for total DNA extraction from western corn rootworm beetles. PLoS One. 2010; 5(8):e11963. [DOI:10.1371/journal.pone.0011963] [PMID] [PMCID]
16.Wang IK, Lai HC, Yu CJ, Liang CC, Chang CT, Kuo HL, et al. Real-time PCR analysis of the intestinal microbiotas in peritoneal dialysis patients. Applied and environmental microbiology. 2012; 78(4):1107-12. [DOI:10.1128/AEM.05605-11] [PMID] [PMCID]
17.Marasco G, Di Biase AR, Schiumerini R, Eusebi LH, Iughetti L, Ravaioli F, et al. Gut microbiota and celiac disease. Digestive Diseases and Sciences. 2016; 61(6):1461-72. [DOI:10.1007/s10620-015-4020-2] [PMID]
18.Aureli P, Capurso L, Castellazzi AM, Clerici M, Giovannini M, Morelli L, et al. Probiotics and health: An evidence-based review. Pharmacological Research. 2011; 63(5):366-76. [DOI:10.1016/j.phrs.2011.02.006] [PMID]
19.Harnett J, Myers SP, Rolfe M. Probiotics and the microbiome in celiac disease: A randomised controlled trial. Evidence-Based Complementary and Alternative Medicine. 2016; 2016:9048574. [DOI:10.1155/2016/9048574] [PMID] [PMCID]
20.Grover S, Rashmi HM, Srivastava AK, Batish VK. Probiotics for human health -new innovations and emerging trends. Gut pathogens. 2012; 4(1):15. [DOI:10.1186/1757-4749-4-15] [PMID] [PMCID
21.Sanz Y, Sanchez E, Marzotto M, Calabuig M, Torriani S, Dellaglio F. Differences in faecal bacterial communities in coeliac and healthy children as detected by PCR and denaturing gradient gel electrophoresis. FEMS Immunology and Medical Microbiology. 2007; 51(3):562-8. [DOI:10.1111/j.1574-695X.2007.00337.x] [PMID]
22.Golfetto L, Duarte de Senna F, Hermes J, Beserra BTS, Franca F, Martinello F. Lower bifidobacteria counts in adult patients with celiac disease on a gluten-free diet. Arquivos de Gastroenterologia. 2014; 51(2):139-43. [DOI:10.1590/S0004-28032014000200013] [PMID]
23.Moraes LF, Grzeskowiak LM, Teixeira TF, Gouveia Peluzio M. Intestinal microbiota and probiotics in celiac disease. Clinical Microbiology Reviews. 2014; 27(3):482-9. [DOI:10.1128/CMR.00106-13] [PMID] [PMCID]
24.Nistal E, Caminero A, Vivas S, Ruiz de Morales JM, Saenz de Miera LE, Rodriguez-Aparicio LB, et al. Differences in faecal bacteria populations and faecal bacteria metabolism in healthy adults and celiac disease patients. Biochimie. 2012; 94(8):1724-9. [DOI:10.1016/j.biochi.2012.03.025] [PMID]
25.Abdullah GA, Jamalludeen NM, Mansour AA. The role of probiotics in celiac disease and their potential effect on immunological and clinical markers of the disease. International Journal of Scientific & Engineering Research. 2017; 8(9):1347-73. [Link]
26.Di Biase AR, Marasco G, Ravaioli F, Dajti E, Colecchia L, Righi B, et al. Gut microbiota signatures and clinical manifestations in celiac disease children at onset: A pilot study. Journal of Gastroenterology and Hepatology. 2021; 36(2):446-54. [DOI:10.1111/jgh.15183] [PMID]
27.Sanchez E, Ribes-Koninckx C, Calabuig M, Sanz Y. Intestinal Staphylococcus spp. and virulent features associated with coeliac disease. Journal of Clinical Pathology. 2012; 65(9):830-4. [DOI:10.1136/jclinpath-2012-200759] [PMID]
28.Collado MC, Donat E, Ribes-Koninckx C, Calabuig M, Sanz Y. Imbalances in faecal and duodenal Bifidobacterium species composition in active and non-active coeliac disease. BMC Microbiology. 2008; 8:232. [DOI:10.1186/1471-2180-8-232] [PMID] [PMCID]
29.De Meij TG, Budding AE, Grasman ME, Kneepkens CM, Savelkoul PH, Mearin ML. Composition and diversity of the duodenal mucosa-associated microbiome in children with untreated coeliac disease. Scandinavian Journal of Gastroenterology. 2013; 48(5):530-6. [DOI:10.3109/00365521.2013.775666] [PMID]
30.Schippa S, Iebba V, Barbato M, Di Nardo G, Totino V, Checchi MP, et al. A distinctive ‘microbial signature’ in celiac pediatric patients. BMC Microbiology. 2010; 10:175. [DOI:10.1186/1471-2180-10-175] [PMID] [PMCID]
31.Olivares M, Neef A, Castillejo G, Palma GD, Varea V, Capilla A, et al. The HLA-DQ2 genotype selects for early intestinal microbiota composition in infants at high risk of developing coeliac disease. Gut. 2015; 64(3):406-17. [DOI:10.1136/gutjnl-2014-306931] [PMID]
32.De Palma G, Nadal I, Collado MC, Sanz Y. Effects of a gluten-free diet on gut microbiota and immune function in healthy adult human subjects. The British Journal of Nutrition. 2009; 102(8):1154-60. [DOI:10.1017/S0007114509371767] [PMID]
33.Nylund L, Hakkola S, Lahti L, Salminen S, Kalliomäki M, Yang B, et al. Diet, perceived intestinal well-being and compositions of fecal microbiota and short chain fatty acids in oat-using subjects with celiac disease or gluten sensitivity. Nutrients. 2020; 12(9):2570.[DOI:10.3390/nu12092570] [PMID] [PMCID]
34.Chander AM, Yadav H, Jain S, Bhadada SK, Dhawan DK. Cross-talk between gluten, intestinal microbiota and intestinal mucosa in Celiac disease: Recent advances and basis of autoimmunity. Frontiers in Microbiology. 2018; 9:2597. [DOI:10.3389/fmicb.2018.02597] [PMID] [PMCID]
متن کامل: (486 مشاهده)
مقدمه
بیماری سلیاک نوعی بیماری خودایمنی مزمن دائمی در روده کوچک است که در اثر مصرف پروتئین گلوتن و درنتیجه عدمتحمل این آنتیژن غذایی در افراد مستعد ازنظر ژنتیکی رخ میدهد [1]. مصرف گلوتن مسئول اصلی بروز علائم و نشانههای بالینی در بیماری سلیاک میباشد. در هنگام مواجهه افراد مستعد با گلوتن، آنزیم ترنس گلوتامیناز بافتی منجر به تغییر در این پروتئین میشود. درنتیجه یک واکنش التهابی در اثر میانکنش بین سیستم ایمنی و بافت روده کوچک ایجاد میشود که این واکنش در مخاط روده، عامل ایجاد آتروفی پرزهای روده، کریپت هایپر پلازیا، افزایش تعداد لنفوسیتها در لامینا پروپریا و سندرم سوءجذب میباشد. در حال حاضر حذف گلوتن از رژیم غذایی، تنها درمان موجود در بیماری سلیاک است [2]. رژیم غذایی بدون گلوتن منجر به بهبودی در علائم و نشانههای بالینی بیماری سلیاک، آسیب مخاطی روده کوچک و یکپارچگی اپیتلیال روده میشود [3].
شیوع بیماری سلیاک هر ساله رو به افزایش است و مکانیسم اساسی این اختلال بهطور کامل شناخته نشده است. معمولاً بیماری سلیاک در اوایل دوران کودکی پس از درمعرض قرار گرفتن فرد با گلوتن ظاهر میشود؛ بااینحال، تعداد افراد مبتلا به بیماری سلیاک که این بیماری را در اوایل و اواخر دوران بزرگسالی تجربه میکنند نیز در حال افزایش میباشند [4]. به همین دلیل، فاکتورهای محیطی دیگری نیز میتوانند در گسترش این بیماری نقش داشته باشند [5]. از این فاکتورهای محیطی میتوان مدتزمان کوتاه شیردهی، عفونتهای روده و تغییرات در میکروبیوتای گوارشی را نام برد [6]. میکروبیوتای گوارشی شامل تعداد بسیار زیادی از گونههای میکروبی میباشد و تعداد ژنهای آن 150 برابر ژنهای ژنوم میزبان است و دارای نقش بسیار مهمی در سلامتی انسان میباشد و در عملکردهای مهم میزبان مانند سوختوساز بدن و فیزیولوژیک آن دخالت دارد [7].
در رابطه با نقش میکروبیوتای گوارشی در بیماری سلیاک مطالعات اندکی انجام شده است؛ بااینحال، نشان داده شده است که تغییر در میکروبیوتای گوارشی-ناتراز شدن یک فاکتور محیطی مهم در بیماریزایی یا پاتوژنز بیماری سلیاک میباشد [8]. میکروبیوتای گوارشی در ایجاد بلوغ ایمنی در بدن و حالت هموستازیس در روده نقش بسیار مهمی دارد. ناتراز شدن در میکروبیوتای گوارشی ممکن است بر هموستازیس روده تأثیر بگذارد و درنتیجه منجر به پاسخ ایمنی بدن به آنتیژنهای غذایی مانند گلوتن شود [9]. اغلب مطالعات نشان میدهند که ناتراز شدن در میکروبیوتای گوارشی افراد مبتلا به بیماری سلیاک با بیماری فعال بهصورت کاهش قابلتوجهی در جمعیت باکتریهای گرم مثبت مفید مانند بیفیدوباکتریوم و لاکتوباسیلوس در نمونههای اثنیعشر و مدفوع رخ میدهد؛ این کاهش، شرایط مناسبی را جهت کلونیزاسیون باکتریهای گرم منفی بیماریزا در سطوح مخاطی در بیماران سلیاکی فراهم میسازد [10].
همچنین نتایج حاصل از مطالعاتی که بر روی نمونه اثنیعشر بیماران سلیاکی صورت گرفته است، نشان میدهد که جمعیت بیفیدوباکتریوم در این بیماران کاهش پیدا کرده است [1]. حضور خانواده بیفیدوباکتریا در مجاری گوارشی منجر به اثرات مفیدی در سلامتی فرد ازجمله ایجاد مقاومت در میزبان در برابر عوامل بیماریزا میشود [11]. علاوهبراین، مطالعاتی که در کودکان مبتلا به سلیاک انجام شده است، کاهش نسبت لاکتوباسیلوس و بیفیدوباکتریوم به باکتریوئیدس را نیز نشان میدهد [12]. سویههای مختلفی از گونههای لاکتوباسیلوس اثرات القایی بیشتری نسبت به اثرات سرکوبگر، بر هر 2 سیستم ایمنی ذاتی و اکتسابی بدن اعمال میکند. سویههایی از لاکتوباسیلوس کازئی منجر به افزایش هر 2 پاسخ موضعی و سیستمیک با واسطه سلولهای تی به گلوتن میشوند [13].
باتوجهبه اهمیت میکروبیوتای رودهای در بیماریزایی بیماری سلیاک و ناتراز شدن در میکروبیوتای رودهای افراد مبتلا به این بیماری، مطالعه حاضر با هدف بررسی تراز 2 میکروب مفید لاکتوباسیلوس و بیفیدوباکتریوم در نمونه مدفوعی بیماران مبتلا به سلیاک نسبت به افراد سالم انجام شده است.
مواد و روشها
این مطالعه آزمایش-کنترل از مرداد 1398 تا بهمن 1398 بر روی20 فرد مبتلا به بیماری سلیاک تحترژیم غذایی فاقد گلوتن بهعنوان گروه آزمایش و 20 فرد سالم بهعنوان گروه کنترل مراجعهکننده به درمانگاه سلیاک مرکز تحقیقات بیماریهای گوارش و کبد دانشگاه علوم پزشکی و خدمات بهداشتی درمانی شهید بهشتی انجام شد. کلیه شرکتکنندگان در این مطالعه در جریان اهداف این طرح تحقیقاتی قرار گرفتهاند. تمام بیماران مبتلا به سلیاک شرکتکننده قبل از ورود به مطالعه دارای آنتیبادیهای ضدترانس گلوتامیناز بافتی و اندومیزیوم در سرم خون بودند. همچنین بیماری آنها توسط بافتشناسی براساس طبقهبندی مارش نیز مورد تأیید قرار گرفت [14].
از شرایط دیگر جهت ورود به مطالعه میتوان به داشتن حداقل 6 ماه رژیم فاقد گلوتن قبل از ورود به مطالعه اشاره کرد. پیش از شروع، فرم رضایتنامه توسط هریک از شرکتکنندگان تکمیل و تأیید شده بود. شرایط خروج از مطالعه موارد زیر بوده است: زنان باردار مبتلا به سلیاک، افراد دارای بیماریهای گوارشی مانند کرون وکولیت زخمی یا کولیت اولسروز یا پس-روده آماس زخمی، افرادی دارای سندرم روده کوتاه، افرادی که مصرف مشروبات الکلی داشتهاند و یا افرادی که وابستگی به مواد مخدر غیرقانونی داشتهاند، افرادی که سابقه عمل جراحی دهان و معده داشتهاند، افراد دارای سرطان و یا ازنظر ویروس اچ آی وی مثبت باشند، افرادی که 4 هفته قبل از مطالعه سابقه مصرف داروهای استروئیدی، آنتیبیوتیک و داروهای ضدالتهابی غیراستروئیدی داشتهاند و افرادی که ازنظر بالینی ناهنجاری در میزان اوره، الکترولیت، کراتینین یا کبد سرم داشتهاند.
اطلاعات جمعیتشناختی افراد شرکتکننده شامل سن، جنس و نتیجه پاتولوژی بیماران براساس طبقهبندی مارش و نیز پرسشنامه تنظیم و ثبت شد. قبل از شروع (روز صفر) و در طول مطالعه نمونه مدفوع از 2 گروه بیماران و کنترل درون ظروف پلاستیکی مخصوص دریافت و جمعآوری شد و تا زمان تحلیل در دمای 80- درجه سانتیگراد نگهداری شد.
استخراج و اندازهگیری غلظت AND
دیانای باکتریایی نمونههای مدفوع افراد مورد مطالعه، توسط کیت استخراج دیانای از مدفوع و مطابق با دستورالعمل گفتهشده در این کیت استخراج شد. بهطور خلاصه، 200 میلیگرم از مدفوع در یک تیوپ استریل، حاوی 300 میکرولیتر از بافر SDE1 و 20 میکرولیتر پروتئیناز K (10 میلیگرم در میلیلیتر) قرار گرفت و بقیه پروتکل نیز مطابق توضیحات سازنده کیت انجام شد. بعد از استخراج دیانای، خلوص و غلظت آن با اندازهگیری نسبت جذب A280/A260 نانومتر توسط دستگاه اسپکتروفوتومتر نانودراپ ترمو آمریکا اندازهگیری شد. درصورتیکه نسبت جذب 260 به 280 بین 1/7 تا 2 باشد، دیانای از خلوص کافی برای انجام واکنش زنجیرهای پلیمراز برخوردار میباشد [15]. دیانای استخراج شده در دمای 80- درجه سانتیگراد ذخیره شد. 2 کاندید باکتریایی ، لاکتوباسیلوس و بیفیدوباکتریوم مورد بررسی قرار گرفتند.
تجزیهوتحلیل میکروبیوتای رودهای توسط تکنیک ریل تایم پی سی آر
جهت انجام تکنیک ریل تایم پیسیآر برای شناسایی و سنجش تعداد کپیهای ژن آر ان ای ریبوزومی 16 سوودبرگ (16S rRNA gene) مربوط به گونههای بیفیدوباکتریوم و تعیین تعداد این باکتری در میکروبیوتای روده از آغازگرهای (پرایمر) اختصاصی Bifid-F با توالی الیگونوکلئوتیدی´-GGGATGCTGGTGTGGAAGAG-3´-´5 و Bifid-R با توالی الیگونوکلئوتیدی 5´-TGCTCGCGTCCACTATCCAG-3´ و برای گونههای لاکتوباسیلوس نیز از پرایمرهای اختصاصی Lacto-F با توالی الیگونوکلئوتیدی 5´-TGGATGCCTTGGCACTAG-3´ و Lacto-R با توالی الیگونوکلئوتیدی 5´-AAATCTCCGGATCAAAGCTTAC-3´ [16] استفاده شد. از دستگاه ترموسایکلر روتورژن-کیو کیاژن و سایبر گرین مستر میکس استفاده شد و تکثیر دیانای در حجم نهایی20 میکرولیتر انجام شد. مقدار اجزای واکنش شامل 10 میکرولیتر از مستر میکس و 10 نانومولار از هریک از آغازگرهای رفت و برگشت و 2 میکرولیتر از دیانای استخراجشده محاسبه شد.
برنامه ریل تایم پیسیآر برای هر تکثیر بهصورت دمای دناتوراسیون اولیه 95 درجه سانتیگراد برای 15 دقیقه، 40 سیکل با برنامه: دناتوراسیون اولیه در دمای 95 درجه سانتیگراد برای 20 ثانیه، اتصال آغازگرها با دمای 56 درجه سانتیگراد برای 30 ثانیه، طویل شدن در دمای 72 درجه سانتیگراد برای 20 ثانیه بود که با مرحله منحنی ذوب باتوجهبه دستورالعمل دستگاه دنبال شد. بعد از انجام واکنش زنجیرهای پلیمراز بازه دمایی 52 درجه سانتیگراد تا 95 درجه سانتیگراد بهمنظور تعیین دمای ذوب و خوانش متوالی با گرادیان دمایی 0/5 درجه سانتیگراد لحاظ شد.
تجزیهوتحلیل منحنی ذوب جهت تأیید ویژگی کثیر انجام شد. غلظت آغازگرها و برنامههای ترموسایکلر برای هریک از واکنشهای زنجیرهای پلیمراز خاص بهینهسازی شد. منحنی استاندارد برای تعیین تعداد کپی ژن آرانای ریبوزومی 16 سوودبرگ هرکدام از باکتریهای کاندید با تولید یک سری رقیق 10 برابر از 101 تا 1010 نسخه ژن آرانای ریبوزومی 16 سوودبرگ در هر واکنش با استفاده از دیانای سویه اشریشیا کلی انجام شد. تعداد نسخه ژن 16S rRNA در گروه از باکتریهای کاندید در نمونههای مدفوع با مقایسه مقادیر سیکل آستانه نمونهها با منحنیهای استاندارد تعیین شد. تمام واکنشها با 3 تکرار مجزا گرفت.
تجزیهوتحلیل دادهها
تجزیهوتحلیل آماری با استفاده از نسخه 21 نرمافزار آماری SPSS انجام شد. تفاوت در معیارهای جمعیتشناختی بین گروههای مورد مطالعه با استفاده از آزمون کایاسکوئر پیرسون برای متغیرهای دستهای مورد ارزیابی قرار گرفت. مقایسه بین 2 گروه مختلف توسط آزمون تی انجام شد. نتایج بهدست آمده بهصورت میانگین±انحرافمعیار بیان شد. در تمام موارد، سطح معناداری آزمونها کمتر از 5 درصد گرفته شده است. تمام تجزیهوتحلیلها برای فراوانی میکروبیوتای روده براساس تعداد سیکل آستانه ارزیابی شد.
یافتهها
مشخصات جمعیتشناختی در 2 گروه بیماران مبتلا به سلیاک تحترژیم غذایی فاقد گلوتن و سالم با مقدار احتمال P مرتبط بهطور کامل مطالعه و تحلیل آماری شدند. شمارش میکروبیوتای رودهای در 20 فرد مبتلا به بیماری سلیاک شامل 9 مرد و 11 زن که قبل از ورود به مطالعه و همچنین در طول مطالعه تحترژیم درمانی فاقد گلوتن قرار داشتند، بهعنوان گروه آزمایش و نیز 20 فرد سالم فاقد سلیاک شامل 10 مرد و 10 زن بهعنوان گروه کنترل ازنظر ترکیب مورد بررسی قرار گرفتند. ازنظر جنسیتی و میانگین سنی افراد در 2 گروه مورد مطالعه از لحاظ آماری اختلاف معناداری نشان ندادند (تصویر شماره 1).
بیماری سلیاک نوعی بیماری خودایمنی مزمن دائمی در روده کوچک است که در اثر مصرف پروتئین گلوتن و درنتیجه عدمتحمل این آنتیژن غذایی در افراد مستعد ازنظر ژنتیکی رخ میدهد [1]. مصرف گلوتن مسئول اصلی بروز علائم و نشانههای بالینی در بیماری سلیاک میباشد. در هنگام مواجهه افراد مستعد با گلوتن، آنزیم ترنس گلوتامیناز بافتی منجر به تغییر در این پروتئین میشود. درنتیجه یک واکنش التهابی در اثر میانکنش بین سیستم ایمنی و بافت روده کوچک ایجاد میشود که این واکنش در مخاط روده، عامل ایجاد آتروفی پرزهای روده، کریپت هایپر پلازیا، افزایش تعداد لنفوسیتها در لامینا پروپریا و سندرم سوءجذب میباشد. در حال حاضر حذف گلوتن از رژیم غذایی، تنها درمان موجود در بیماری سلیاک است [2]. رژیم غذایی بدون گلوتن منجر به بهبودی در علائم و نشانههای بالینی بیماری سلیاک، آسیب مخاطی روده کوچک و یکپارچگی اپیتلیال روده میشود [3].
شیوع بیماری سلیاک هر ساله رو به افزایش است و مکانیسم اساسی این اختلال بهطور کامل شناخته نشده است. معمولاً بیماری سلیاک در اوایل دوران کودکی پس از درمعرض قرار گرفتن فرد با گلوتن ظاهر میشود؛ بااینحال، تعداد افراد مبتلا به بیماری سلیاک که این بیماری را در اوایل و اواخر دوران بزرگسالی تجربه میکنند نیز در حال افزایش میباشند [4]. به همین دلیل، فاکتورهای محیطی دیگری نیز میتوانند در گسترش این بیماری نقش داشته باشند [5]. از این فاکتورهای محیطی میتوان مدتزمان کوتاه شیردهی، عفونتهای روده و تغییرات در میکروبیوتای گوارشی را نام برد [6]. میکروبیوتای گوارشی شامل تعداد بسیار زیادی از گونههای میکروبی میباشد و تعداد ژنهای آن 150 برابر ژنهای ژنوم میزبان است و دارای نقش بسیار مهمی در سلامتی انسان میباشد و در عملکردهای مهم میزبان مانند سوختوساز بدن و فیزیولوژیک آن دخالت دارد [7].
در رابطه با نقش میکروبیوتای گوارشی در بیماری سلیاک مطالعات اندکی انجام شده است؛ بااینحال، نشان داده شده است که تغییر در میکروبیوتای گوارشی-ناتراز شدن یک فاکتور محیطی مهم در بیماریزایی یا پاتوژنز بیماری سلیاک میباشد [8]. میکروبیوتای گوارشی در ایجاد بلوغ ایمنی در بدن و حالت هموستازیس در روده نقش بسیار مهمی دارد. ناتراز شدن در میکروبیوتای گوارشی ممکن است بر هموستازیس روده تأثیر بگذارد و درنتیجه منجر به پاسخ ایمنی بدن به آنتیژنهای غذایی مانند گلوتن شود [9]. اغلب مطالعات نشان میدهند که ناتراز شدن در میکروبیوتای گوارشی افراد مبتلا به بیماری سلیاک با بیماری فعال بهصورت کاهش قابلتوجهی در جمعیت باکتریهای گرم مثبت مفید مانند بیفیدوباکتریوم و لاکتوباسیلوس در نمونههای اثنیعشر و مدفوع رخ میدهد؛ این کاهش، شرایط مناسبی را جهت کلونیزاسیون باکتریهای گرم منفی بیماریزا در سطوح مخاطی در بیماران سلیاکی فراهم میسازد [10].
همچنین نتایج حاصل از مطالعاتی که بر روی نمونه اثنیعشر بیماران سلیاکی صورت گرفته است، نشان میدهد که جمعیت بیفیدوباکتریوم در این بیماران کاهش پیدا کرده است [1]. حضور خانواده بیفیدوباکتریا در مجاری گوارشی منجر به اثرات مفیدی در سلامتی فرد ازجمله ایجاد مقاومت در میزبان در برابر عوامل بیماریزا میشود [11]. علاوهبراین، مطالعاتی که در کودکان مبتلا به سلیاک انجام شده است، کاهش نسبت لاکتوباسیلوس و بیفیدوباکتریوم به باکتریوئیدس را نیز نشان میدهد [12]. سویههای مختلفی از گونههای لاکتوباسیلوس اثرات القایی بیشتری نسبت به اثرات سرکوبگر، بر هر 2 سیستم ایمنی ذاتی و اکتسابی بدن اعمال میکند. سویههایی از لاکتوباسیلوس کازئی منجر به افزایش هر 2 پاسخ موضعی و سیستمیک با واسطه سلولهای تی به گلوتن میشوند [13].
باتوجهبه اهمیت میکروبیوتای رودهای در بیماریزایی بیماری سلیاک و ناتراز شدن در میکروبیوتای رودهای افراد مبتلا به این بیماری، مطالعه حاضر با هدف بررسی تراز 2 میکروب مفید لاکتوباسیلوس و بیفیدوباکتریوم در نمونه مدفوعی بیماران مبتلا به سلیاک نسبت به افراد سالم انجام شده است.
مواد و روشها
این مطالعه آزمایش-کنترل از مرداد 1398 تا بهمن 1398 بر روی20 فرد مبتلا به بیماری سلیاک تحترژیم غذایی فاقد گلوتن بهعنوان گروه آزمایش و 20 فرد سالم بهعنوان گروه کنترل مراجعهکننده به درمانگاه سلیاک مرکز تحقیقات بیماریهای گوارش و کبد دانشگاه علوم پزشکی و خدمات بهداشتی درمانی شهید بهشتی انجام شد. کلیه شرکتکنندگان در این مطالعه در جریان اهداف این طرح تحقیقاتی قرار گرفتهاند. تمام بیماران مبتلا به سلیاک شرکتکننده قبل از ورود به مطالعه دارای آنتیبادیهای ضدترانس گلوتامیناز بافتی و اندومیزیوم در سرم خون بودند. همچنین بیماری آنها توسط بافتشناسی براساس طبقهبندی مارش نیز مورد تأیید قرار گرفت [14].
از شرایط دیگر جهت ورود به مطالعه میتوان به داشتن حداقل 6 ماه رژیم فاقد گلوتن قبل از ورود به مطالعه اشاره کرد. پیش از شروع، فرم رضایتنامه توسط هریک از شرکتکنندگان تکمیل و تأیید شده بود. شرایط خروج از مطالعه موارد زیر بوده است: زنان باردار مبتلا به سلیاک، افراد دارای بیماریهای گوارشی مانند کرون وکولیت زخمی یا کولیت اولسروز یا پس-روده آماس زخمی، افرادی دارای سندرم روده کوتاه، افرادی که مصرف مشروبات الکلی داشتهاند و یا افرادی که وابستگی به مواد مخدر غیرقانونی داشتهاند، افرادی که سابقه عمل جراحی دهان و معده داشتهاند، افراد دارای سرطان و یا ازنظر ویروس اچ آی وی مثبت باشند، افرادی که 4 هفته قبل از مطالعه سابقه مصرف داروهای استروئیدی، آنتیبیوتیک و داروهای ضدالتهابی غیراستروئیدی داشتهاند و افرادی که ازنظر بالینی ناهنجاری در میزان اوره، الکترولیت، کراتینین یا کبد سرم داشتهاند.
اطلاعات جمعیتشناختی افراد شرکتکننده شامل سن، جنس و نتیجه پاتولوژی بیماران براساس طبقهبندی مارش و نیز پرسشنامه تنظیم و ثبت شد. قبل از شروع (روز صفر) و در طول مطالعه نمونه مدفوع از 2 گروه بیماران و کنترل درون ظروف پلاستیکی مخصوص دریافت و جمعآوری شد و تا زمان تحلیل در دمای 80- درجه سانتیگراد نگهداری شد.
استخراج و اندازهگیری غلظت AND
دیانای باکتریایی نمونههای مدفوع افراد مورد مطالعه، توسط کیت استخراج دیانای از مدفوع و مطابق با دستورالعمل گفتهشده در این کیت استخراج شد. بهطور خلاصه، 200 میلیگرم از مدفوع در یک تیوپ استریل، حاوی 300 میکرولیتر از بافر SDE1 و 20 میکرولیتر پروتئیناز K (10 میلیگرم در میلیلیتر) قرار گرفت و بقیه پروتکل نیز مطابق توضیحات سازنده کیت انجام شد. بعد از استخراج دیانای، خلوص و غلظت آن با اندازهگیری نسبت جذب A280/A260 نانومتر توسط دستگاه اسپکتروفوتومتر نانودراپ ترمو آمریکا اندازهگیری شد. درصورتیکه نسبت جذب 260 به 280 بین 1/7 تا 2 باشد، دیانای از خلوص کافی برای انجام واکنش زنجیرهای پلیمراز برخوردار میباشد [15]. دیانای استخراج شده در دمای 80- درجه سانتیگراد ذخیره شد. 2 کاندید باکتریایی ، لاکتوباسیلوس و بیفیدوباکتریوم مورد بررسی قرار گرفتند.
تجزیهوتحلیل میکروبیوتای رودهای توسط تکنیک ریل تایم پی سی آر
جهت انجام تکنیک ریل تایم پیسیآر برای شناسایی و سنجش تعداد کپیهای ژن آر ان ای ریبوزومی 16 سوودبرگ (16S rRNA gene) مربوط به گونههای بیفیدوباکتریوم و تعیین تعداد این باکتری در میکروبیوتای روده از آغازگرهای (پرایمر) اختصاصی Bifid-F با توالی الیگونوکلئوتیدی´-GGGATGCTGGTGTGGAAGAG-3´-´5 و Bifid-R با توالی الیگونوکلئوتیدی 5´-TGCTCGCGTCCACTATCCAG-3´ و برای گونههای لاکتوباسیلوس نیز از پرایمرهای اختصاصی Lacto-F با توالی الیگونوکلئوتیدی 5´-TGGATGCCTTGGCACTAG-3´ و Lacto-R با توالی الیگونوکلئوتیدی 5´-AAATCTCCGGATCAAAGCTTAC-3´ [16] استفاده شد. از دستگاه ترموسایکلر روتورژن-کیو کیاژن و سایبر گرین مستر میکس استفاده شد و تکثیر دیانای در حجم نهایی20 میکرولیتر انجام شد. مقدار اجزای واکنش شامل 10 میکرولیتر از مستر میکس و 10 نانومولار از هریک از آغازگرهای رفت و برگشت و 2 میکرولیتر از دیانای استخراجشده محاسبه شد.
برنامه ریل تایم پیسیآر برای هر تکثیر بهصورت دمای دناتوراسیون اولیه 95 درجه سانتیگراد برای 15 دقیقه، 40 سیکل با برنامه: دناتوراسیون اولیه در دمای 95 درجه سانتیگراد برای 20 ثانیه، اتصال آغازگرها با دمای 56 درجه سانتیگراد برای 30 ثانیه، طویل شدن در دمای 72 درجه سانتیگراد برای 20 ثانیه بود که با مرحله منحنی ذوب باتوجهبه دستورالعمل دستگاه دنبال شد. بعد از انجام واکنش زنجیرهای پلیمراز بازه دمایی 52 درجه سانتیگراد تا 95 درجه سانتیگراد بهمنظور تعیین دمای ذوب و خوانش متوالی با گرادیان دمایی 0/5 درجه سانتیگراد لحاظ شد.
تجزیهوتحلیل منحنی ذوب جهت تأیید ویژگی کثیر انجام شد. غلظت آغازگرها و برنامههای ترموسایکلر برای هریک از واکنشهای زنجیرهای پلیمراز خاص بهینهسازی شد. منحنی استاندارد برای تعیین تعداد کپی ژن آرانای ریبوزومی 16 سوودبرگ هرکدام از باکتریهای کاندید با تولید یک سری رقیق 10 برابر از 101 تا 1010 نسخه ژن آرانای ریبوزومی 16 سوودبرگ در هر واکنش با استفاده از دیانای سویه اشریشیا کلی انجام شد. تعداد نسخه ژن 16S rRNA در گروه از باکتریهای کاندید در نمونههای مدفوع با مقایسه مقادیر سیکل آستانه نمونهها با منحنیهای استاندارد تعیین شد. تمام واکنشها با 3 تکرار مجزا گرفت.
تجزیهوتحلیل دادهها
تجزیهوتحلیل آماری با استفاده از نسخه 21 نرمافزار آماری SPSS انجام شد. تفاوت در معیارهای جمعیتشناختی بین گروههای مورد مطالعه با استفاده از آزمون کایاسکوئر پیرسون برای متغیرهای دستهای مورد ارزیابی قرار گرفت. مقایسه بین 2 گروه مختلف توسط آزمون تی انجام شد. نتایج بهدست آمده بهصورت میانگین±انحرافمعیار بیان شد. در تمام موارد، سطح معناداری آزمونها کمتر از 5 درصد گرفته شده است. تمام تجزیهوتحلیلها برای فراوانی میکروبیوتای روده براساس تعداد سیکل آستانه ارزیابی شد.
یافتهها
مشخصات جمعیتشناختی در 2 گروه بیماران مبتلا به سلیاک تحترژیم غذایی فاقد گلوتن و سالم با مقدار احتمال P مرتبط بهطور کامل مطالعه و تحلیل آماری شدند. شمارش میکروبیوتای رودهای در 20 فرد مبتلا به بیماری سلیاک شامل 9 مرد و 11 زن که قبل از ورود به مطالعه و همچنین در طول مطالعه تحترژیم درمانی فاقد گلوتن قرار داشتند، بهعنوان گروه آزمایش و نیز 20 فرد سالم فاقد سلیاک شامل 10 مرد و 10 زن بهعنوان گروه کنترل ازنظر ترکیب مورد بررسی قرار گرفتند. ازنظر جنسیتی و میانگین سنی افراد در 2 گروه مورد مطالعه از لحاظ آماری اختلاف معناداری نشان ندادند (

نتایج حاصل از این مطالعه نشان میدهد که سیکل آستانه میزان باکتریهای بیفیدوباکتریوم و لاکتوباسیلوس در افراد مبتلا به سلیاک در مقایسه با گروه سالم بهطور معناداری بالاتر میباشد (0/05>P). ازآنجاییکه سیکل آستانه با میزان شمارش نسبت عکس دارد، میزان شمارش این 2 باکتری مفید مورد بررسی در بیماران سلیاکی در مقایسه با افراد سالم بهطور معناداری کمتر میباشد (0/05>P).
بحث
شواهد اخیر در رابطه با بیماری سلیاک نشان داده است که ایمنی ذاتی در تحریک پاسخ ایمنی ازطریق تحریک پاسخ ایمنی اکتسابی و آسیب مخاطی نقش بسیار مهمی دارد. اتصال میکروبیوتای رودهای با دیواره مخاط روده ازطریق همان گیرندههایی انجام میشود که ایمنی ذاتی را میتوانند فعال کنند. بنابراین، تغییر در میکروبیوتای روده ممکن است به فعال شدن این مسیر التهابی منجر شود [17]. درواقع، گونههای مفید میکروبیوتای روده در بیماران مبتلا به بیماری سلیاک کاهش یافته و از طرفی گونههای بیماریزا بهطور بالقوه نسبت به افراد سالم افزایش پیدا میکنند. در این بیماران اگرچه بعد از رژیم غذایی فاقد گلوتن، ناترازی در میکروبیوتای رودهای کاهش مییابد، اما بهطورکامل از بین نمیرود. بنابراین، میکروبیوتای رودهای نقش حائز اهمیتی را در پاتوژنز یا بیماریزایی بیماری سلیاک دارد [18, 19, 20].
ازطرفی مطالعات کمتری تعداد و ترکیب میکروبیوتای رودهای و نقش آن در پاتوژنز بیماری سلیاک و همچنین مقایسه ترکیب میکروبیوتای رودهای در افراد مبتلا به بیماری سلیاک درمقایسه با افراد فاقد این بیماری را مورد بررسی قرار دادهاند. بنابراین در مطالعه حاضر ترکیب میکروبیوتای رودهای مشخص ازجمله بیفیدوباکتریوم و لاکتوباسیلوس در بیماران مبتلا به سلیاک در مقایسه با افراد سالم مورد بررسی قرار گرفته است و نشان داده شد که جمعیت میکروبیوتای رودهای در بیماران سلیاکی، تفاوتهای معناداری را در مقایسه با افراد سالم دارند؛ بدینگونه که افراد بیمار میزان کمتری از باکتریهای رودهای مفید بیفیدوباکتریوم و لاکتوباسیلوس را نسبت به افراد سالم دارند. بررسی تنوع میکروبیوتای رودهای در افراد مبتلا به بیماری سلیاک در مقایسه با افراد سالم در مطالعات گوناگونی انجام شده است که نتایج حاصل از مطالعه حاضر را نیز تأیید میکنند [10، 21].
گلفتو و همکاران نظر موافقی با نتایج حاصل از مطالعه حاضر در جهت پایین بودن میزان بیفیدوباکتریوم و ناترازی در میکروبیوتای رودهای در بیماران مبتلا به بیماری سلیاک حتی با وجود رعایت رژیم غذایی فاقد گلوتن ارائه کردند که این واقعیت حمایتکننده روند پاتولوژیک بیماری سلیاک میباشد [22]. مشابه پژوهش حاضر، مطالعه مورایس و همکاران میباشد که تفاوت در پروفایل میکروبی بین کودکان مبتلا به بیماری سلیاک و گروه کنترل را گزارش کردند و نشان دادند که بیماران سلیاکی میزان کمتری از لاکتوباسیل و بیفیدوباکتریوم را در مقایسه با افراد سالم دارند. بررسیها نشان دادهاند که بیفیدوباکتریوم و لاکتوباسیلوس که جزء پروبیوتیکها نیز میباشند، میتوانند در هضم یا تغییر پلیپپتیدهای گلوتن نقش داشته باشند. ازطرفی برخی از گونههای باکتریایی متعلق به جنس لاکتوباسیلوس و بیفیدوباکتریوم نقش حفاظتی بر روی سلولهای اپیتلیال در برابر آسیبهای ناشی از گلیادین دارند [23].
کولادو و همکاران در مطالعهای مشابه با مطالعه حاضر با هدف شناسایی باکتریهای روده اختصاصی مرتبط با بیماری سلیاک در تشخیص و پس از درمان با رژیم فاقد گلوتن، نمونه مدفوع کودکان مبتلا به سلیاک درماننشده و تحترژیم فاقد گلوتن، نمونه بیوپسی بیماران مبتلا به سلیاک درماننشده و تحترژیم فاقد گلوتن و نمونه مدفوع و بیوپسی کودکان سالم بهعنوان گروه کنترل را برای مقایسه بین 2 گروه مورد بررسی قرار دادند و از روش ریل تایم پیسیآر برای اندازهگیری باکتریهای روده استفاده کردند. نتایج حاصل از این مطالعه تفاوت بین تعداد برخی از میکروبیوتای رودهای مانند باکتریوئیدس و کلستریدیوم لپتوم را بین کودکان مبتلا به سلیاک نسبت به گروه کنترل صرفنظر از مرحله بیماری و همچنین تفاوت در تعداد کولای و استافیلوکوکوس را درکودکان مبتلا به سلیاک درماننشده در مقایسه با گروه کنترل نشان دادند. همچنین در این مطالعه، میزان کمتری از بیفیدوباکتریوم در مدفوع هر 2 گروه از بیماران و بیوپسی افراد درماننشده در مقایسه با گروه کنترل نیز گزارش شد [10].
در مطالعه مشابه دیگری که توسط سانز و همکاران انجام شد، میزان شمارش میکروبیوتای مدفوعی در جمعیت کودکان مبتلا به بیماری سلیاک نسبت به کنترلهای همسان با سن توسط تکنیک زنجیرهای پلیمراز و الکتروفورز ژل گرادیان دناتوره مورد تجزیهوتحلیل قرار گرفت و افزایش معناداری را در جمعیت میکروبیوتای مدفوع در بیماران مبتلا به سلیاک نسبت به افراد سالم گزارش کردند. از طرفی در بیماران مبتلا به سلیاک حضور اختصاصی گونههای لاکتوباسیلوس کورواتوس و در گروه سالم حضور لاکتوباسیلوس کازئی بهعنوان گونه باکتری مشخصه این گروه را نیز مشاهده کردند. همچنین میزان شمارش گونه بیفیدو باکتریوم بهطور قابلتوجهی در گروه دارای سلیاک نسبت به گروه سالم کمتر بود [22].
نیستال و همکاران مطالعهای مشابه با مطالعه حاضر با هدف بررسی تفاوت در میکروبیوتای روده در بزرگسالان مبتلا به سلیاک و افراد سالم انجام دادند و توسط تکنیکهای الکتروفورز ژنتیکی شیب و کروماتوگرافی مایع گازی از اسیدهای چرب زنجیره کوتاه، جوامع میکروبی را در نمونههای مدفوع بیماران مبتلا به سلیاک درماننشده، بیماران سلیاکی تحتدرمان با رژیم فاقد گلوتن و جمعیت سالم سنجیدند و کاهش در تنوع گونههای لاکتوباسیلوس و بیفیدوباکتریوم را در بیماران سلیاکی تحت درمان، مشاهده کردند. همچنین گروه سلیاکی تحتدرمان نسبت به بزرگسالان سالم بهطور معناداری میزان بیشتری از حضور بیفیدوباکتریوم بیفیدوم را نشان داد. نتایج کلی حاصل از این مطالعه تفاوت در میکروبیوتای مدفوعی بیماران سلیاکی درماننشده نسبت به افراد سالم را نشان داد. نیستال و همکاران نیز با نظر موافقی با مطالعه حاضر نشان دادند که رژیم غذایی فاقد گلوتن در بیماران سلیاکی اگرچه تا حدی میکروبیوتای گوارشی را در این بیماران به حالت طبیعی برمیگرداند، اما باوجوداین در این بیماران تنوع لاکتوباسیلوس و بیفیدوباکتریوم به میزان قابلتوجهی کاهش مییابد [24].
در مطالعه مشابه دیگری که در سال 2020 توسط نایلوند و همکاران بر روی بیماران مبتلا به سلیاک و افراد حساس به گلوتن فاقد سلیاک تحت رژیم غذایی فاقد گلوتن و افراد سالم مصرفکننده جوی دوسر انجام شد، ترکیب میکروبیوتای مدفوعی در گروههای مورد مطالعه بررسی شد و نتایج حاصل نشان داد که اگرچه در بزرگسالان سالم فراوانی بیفیدوباکتریوم در مقایسه با بیماران سلیاکی و گروه حساس به گلوتن فاقد سلیاک به سمت بالاتری گرایش داشت، اما اختلاف معناداری ازنظر گوناگونی در ترکیب میکروبی در گروههای مورد مطالعه نشان نداد [25].
در مطالعه دی بیاس و همکاران ترکیب میکروبیوتای گوارشی را در نمونههای مدفوع و 12 کودکان مبتلا به سلیاک در شروع بیماری با گروه سالم مقایسه کردند. نتایج کلی حاصل از این مطالعه نیز مشابه با مطالعه حاضر تفاوت در میکروبیوتای گوارشی در کودکان مبتلا به سلیاک را در شروع بیماری در مقایسه با گروه سالم نشان داد. کاهش در فراوانی باکتریهای مفیدی مانند باکتروئیدس/پریووتلا و آکرمانسیا در نمونه مدفوع بیماران مبتلا به سلیاک در مقایسه با گروه سالم نیز مشاهده شد [26]. علاوهبراین، برخی مطالعات دیگر نیز نتایج مطالعه حاضر را تأیید کردند و ثابت میکند که 2 باکتری مفید بیفیدوباکتریوم و لاکتوباسیلوس میتوانند در بیماران مبتلا به بیماری سلیاک نقش محافظتی را در برابر پاسخ التهابی و آسیب مخاطی ناشی از پپتیدهای گلیادین داشته باشند. همچنین نقشهای درمانی این پروبیوتیکها را نیز توضیح میدهند [19, 20, 21, 22, 23, 24, 25]. کاهش میزان باکتریهای مفید مانند لاکتوباسیلوس و بیفیدوباکتریوم در بیماران دارای سلیاک منجر به افزایش پاتوژنهای فرصتطلب در بیماران دارای سلیاک و درنهایت منجر به نقص سیتم ایمنی این بیماران میشود [27].
براساس مطالعات پیشین، میکروبیوتای رودهای در بیماران مبتلا به بیماری سلیاک با وجود رعایت رژیم غذایی فاقد گلوتن بهطور کامل ترمیم نمیشود [10] و میزان برخی از باکتریهای مفید گوارشی مانند بیفیدوباکتریوم در افراد دارای سلیاک با وجود این نوع رژیم باز هم نسبت به افراد سالم بهطور معناداری کمتر میباشد. اگرچه نتایج حاصل از اکثریت مطالعات صورتگرفته درزمینه بررسی تنوع میکروبیوتای رودهای بیماران دارای سلیاک تحت رژیم فاقد گلوتن و مقایسه آن با افراد سالم در سرتاسر جهان، تنوع و شمارش متفاوت میکروبیوتای رودهای این بیماران با افراد سالم را نشان میدهند [28]. این نتایج همگی مؤید نتایج بررسی کنونی میباشد. در بررسی کنونی جامعه هدف بیماران و افراد سالم میانسال در جامعه شهری و با رژیم غذایی میانه و معمول بودهاند. این افراد در بررسی و در مقایسه با گروه افراد سالم دارای ناترازی در میزان پروبیوتیکهای طبیعی فلور بودهاند. میزان لاکتوباسیلوس و بیفیدیدیوباکتریوم دفعشده در این افراد کمتر از گروه سالم میباشد که بازتابی از وضعیت فلور رودهای این افراد است که ناشی از وضعیت ناتراز فلور میکربی و فقر باکتریهای پروبیوتیک در سیستم گوارشی این افراد میباشد. درمقابل، مطالعاتی هم بودند که هیچ تفاوتی را بین میکروبیوتای رودهای بیماران دارای سلیاک تحترژیم فاقد گلوتن و گروه کنترل نشان نداند و اعلام کردند که به نظر میرسد میکروبیوتای رودهای نقشی در پاتوژنز بیماری سلیاک ندارد [29]. از طرفی داشتن این نوع رژیم غذایی در این بیماران، براساس نتایج مطالعات پیشین تنها منجر به بهبود بخشی از میکروبیوتای رودهای میشود [30] که دلایل آن نیز بهطور قطعی مشخص نمیباشد، اما عواملی مانند ژنتیک بیمار مبتلا به سلیاک با وجود رژیم غذایی فاقد گلوتن به احتمال زیاد میتواند بر ترکیب میکروبیوتای روده اثرگذار باشد [31]. از طرفی گلوتن دارای یک عملکرد پربیوتیک مانند است که حذف این پروتئین از رژیم فاقد گلوتن نیز میتواند در ایجاد یک میکروبیوتای روده متفاوت در این بیماران در مقایسه با افراد سالم شود [32]. بنابراین، درمجموع میتوان بیان کرد که با اصلاح سیستم تغذیهای با رویکرد تقویت سیستم پروبیوتیک سیستم گوارشی و تنظیم پایایی و زیستایی آنها بتوان عوارض بیماری سلیاک را که به نوعی نقص در سیستم ژنی با محرکهای اپی ژنیک است، تعدیل کرد.
ازنظر فیزیولوژیک باتوجهبه آتروفی پرزهای رودهای در این بیماری، شاید نقص در حفظ تراز فلور میکربی طبیعی را بتوان علاوهبر آنکه از عوارض ناشی از این بیماری دانست، در رویکردی دیگر خود این عامل را مسبب تشدید این بیماری قلمداد کرد. باتوجهبه سایر عوامل محیطی و زیستی مؤثر این سلسله از عوامل را بروز شرایط فقر تغذیهای و نقص در سطوح طبیعی ریزمغذیها دانست [16، 33، 34]. عوامل در مطالعه حاضر، میکروبیوتای رودهای و کاهش در میزان باکتریهای مفید بیفیدوباکتریوم و لاکتوباسیلوس بین 2 گروه مورد مطالعه متفاوت و در گروه دارای عارضه سلیاک کاهش یافته است. باتوجهبه حجم نمونه گزارششده، با قاطعیت نمیتوان این تفاوت بین میکروبیوتای رودهای افراد مبتلا به سلیاک و سالم را گزارش کرد و نیاز به انجام مطالعه در حجم نمونههای بزرگتر میباشد.
همانگونه که در بخش یافتهها نشان داده شد، نتایج حاصل از 2 آزمون کایاسکوئر پیرسون برای متغیرهای دستهای و آزمون تی برای متغیرهای عددی که بهمنظور تعیین یکپارچگی بین 2 گروه آزمایش و کنترل در تجزیهوتحلیل آماری دادههای جمعیتشناختی انجام شد، نشان داد که 2 گروه مورد مطالعه ازنظر دادههای جمعیتشناختی با هم اختلاف معناداری ندارند. این مسئله نقطه قوت مطالعه حاضر میباشد؛ زیرا این نتایج یکپارچگی بین 2 گروه مورد مطالعه را تأیید و 2 گروه را بهراحتی قابل مقایسه و بررسی کرده است.
مطالعه حاضر دارای محدودیتهایی بود. اولاً، این مطالعه در حجم نمونه کمی و در یک مرکز واحد در تهران، ایران انجام شده است.
محدودیت دیگر مطالعه حاضر مدتزمان محدود مطالعه و انتخاب بیمار بود.
نتیجهگیری
مطالعه حاضر همسو با سایر مطالعات، پدیده ناترازشدن میکروبیوتای روده در بیماران مبتلا به سلیاک نسبت به افراد سالم را نشان میدهد. درنتیجه میتوان گفت، بررسی میکروبیوتای مدفوع میتواند نشانگر خوبی از پدیده ناترازشدن میکروبیوتای روده در بیماران مبتلا به سلیاک باشد و میتواند برای نظارت بر ترمیم میکروبیوتا در طی رژیم فاقد گلوتن مورداستفاده قرار گیرد؛ بهطوریکه دادههای مربوط به متابولیک همراه با ارزیابی میکروبیوتای روده بیماران میتواند به پزشکان در ارزیابی نقش میکروبیوتای رودهای در روند بیماریزایی یا پاتوژنزیس بیماری سلیاک و همچنین بررسیهای بیشتر کمک کند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
پیروی از اصول اخلاق پژوهش پژوهشگران همه کدهای اخلاقی مربوط به تحقیقات بر روی نمونههای انسانی رعایت شده و مجوزهای لازم را از مراجع صاحب صلاحیت دریافت شده است. این مطالعه با کد اخلاق IR.SBMU.RIGLD.REC.1395.114 کمیته اخلاق مرکز تحقیقات بیماریهای گوارش و کبد دانشگاه علوم پزشکی و خدمات درمانی شهید بهشتی و با کد ثبت IRCT20171225038063N1 مرکز ثبت کارآزمایی بالینی ایران (IRCT) به تصویب رسید.
حامی مالی
این تحقیق با حمایت مالی مرکز تحقیقات بیماریهای گوارش و کبد دانشگاه علوم پزشکی و خدمات درمانی شهید بهشتی انجام شده است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتند.تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان این مقاله از معاونت پژوهشی و همکاران پژوهشکده بیماریهای گوارش و کبد دانشگاه علوم پزشکی و خدمات درمانی شهید بهشتی و مسئولین محترم دانشگاه آزاد اسلامی واحد کرج به دلیل حمایتهای بیدریغشان تشکر و قدردانی میشود.
References
1.Nadal I, Donant E, Ribes-Koninckx C, Calabuig M, Sanz Y. Imbalance in the composition of the duodenal microbiota of children with coeliac disease. Journal of Medical Microbiology. 2007; 56(Pt 12):1669-74. [DOI:10.1099/jmm.0.47410-0] [PMID]
2.Di Sabatino A, Corazza GR. Coeliac disease. Lancet. 2009; 373(9673):1480-93. [DOI:10.1016/S0140-6736(09)60254-3] [PMID]
3.Kaukinen K, Lindfors K, Collin P, Koskinen O, Mäki M. Coeliac disease-a diagnostic and therapeutic challenge. Clinical Chemistry and Laboratory Medicine. 2010; 48(9):1205-16. [DOI:10.1515/cclm.2010.241] [PMID]
4.Catassi C, Kryszak D, Bhatti B, Sturgeon C, Helzlsouer K, Clipp SL, et al. Natural history of celiac disease autoimmunity in a USA cohort followed since 1974. Annals of Medicine. 2010; 42(7):530-8. [DOI:10.3109/07853890.2010.514285] [PMID]
5.Sanz Y, De Pama G, Laparra M. Unraveling the ties between celiac disease and intestinal microbiota. International Reviews of Immunology. 2011; 30(4):207-18. [DOI:10.3109/08830185.2011.599084] [PMID]
6.Ghosh S. Advances in our understanding of the pathogenesis of celiac disease. Canadian Journal of Gastroenterology . 2011; 25(4):186. [DOI:10.1155/2011/684230] [PMID] [PMCID]
7.Guarner F, Malagelada JR. Gut flora in health and disease. Lancet. 2003; 361(9356):512-9. [DOI:10.1016/S0140-6736(03)12489-0] [PMID]
8.Cristofori F, Indrio F, Miniello VL, De Angelis M, Francavilla R. Probiotics in celiac disease. Nutrients. 2018; 10(12):1824. [DOI:10.3390/nu10121824] [PMID] [PMCID]
9.Nakayama J, Kobayashi T, Tanaka S, Korenori Y, Tateyama A, Sakamoto N, et al. Aberrant structures of fecal bacterial community in allergic infants profiled by 16S rRNA gene pyrosequencing. FEMS Immunology and Medical Microbiology. 2011; 63(3):397-406. [DOI:10.1111/j.1574-695X.2011.00872.x] [PMID]
10.Collado MC, Donat E, Ribes-Koninckx C, Calabuig M, Sanz Y. Specific duodenal and faecal bacterial groups associated with paediatric coeliac disease. Journal of Clinical Pathology. 2009; 62(3):264-9. [DOI:10.1136/jcp.2008.061366] [PMID]
11.Davis CD, Milner JA. Gastrointestinal microflora, food components and colon cancer prevention. The Journal of Nutritional Biochemistry. 2009; 20(10):743-52. [DOI:10.1016/j.jnutbio.2009.06.001] [PMID] [PMCID]
12.Ou G, Hedberg M, Horstedt P, Baranov V, Forsberg G, Drobni M,et al. Proximal small intestinal microbiota and identification of rod-shaped bacteria associated with childhood celiac disease. The American Journal of Gastroenterology. 2009; 104(12):3058-67. [DOI:10.1038/ajg.2009.524] [PMID]
13.Sanders ME. Impact of probiotics on colonizing microbiota of the gut. Journal of Clinical Gastroenterology. 2011; 45(S):S115-9. [DOI:10.1097/MCG.0b013e318227414a] [PMID]
14.Marsh MN, Johnson MW, Rostami K. Mucosal histopathology in celiac disease: A rebuttal of Oberhuber’s sub-division of Marsh III. Gastroenterology and Hepatology from Bed to Bench. 2015; 8(2):99-109. [PMID]
15.Chen H, Rangasamy M, Tan SY, Wang H, Siegfried BD. Evaluation of five methods for total DNA extraction from western corn rootworm beetles. PLoS One. 2010; 5(8):e11963. [DOI:10.1371/journal.pone.0011963] [PMID] [PMCID]
16.Wang IK, Lai HC, Yu CJ, Liang CC, Chang CT, Kuo HL, et al. Real-time PCR analysis of the intestinal microbiotas in peritoneal dialysis patients. Applied and environmental microbiology. 2012; 78(4):1107-12. [DOI:10.1128/AEM.05605-11] [PMID] [PMCID]
17.Marasco G, Di Biase AR, Schiumerini R, Eusebi LH, Iughetti L, Ravaioli F, et al. Gut microbiota and celiac disease. Digestive Diseases and Sciences. 2016; 61(6):1461-72. [DOI:10.1007/s10620-015-4020-2] [PMID]
18.Aureli P, Capurso L, Castellazzi AM, Clerici M, Giovannini M, Morelli L, et al. Probiotics and health: An evidence-based review. Pharmacological Research. 2011; 63(5):366-76. [DOI:10.1016/j.phrs.2011.02.006] [PMID]
19.Harnett J, Myers SP, Rolfe M. Probiotics and the microbiome in celiac disease: A randomised controlled trial. Evidence-Based Complementary and Alternative Medicine. 2016; 2016:9048574. [DOI:10.1155/2016/9048574] [PMID] [PMCID]
20.Grover S, Rashmi HM, Srivastava AK, Batish VK. Probiotics for human health -new innovations and emerging trends. Gut pathogens. 2012; 4(1):15. [DOI:10.1186/1757-4749-4-15] [PMID] [PMCID
21.Sanz Y, Sanchez E, Marzotto M, Calabuig M, Torriani S, Dellaglio F. Differences in faecal bacterial communities in coeliac and healthy children as detected by PCR and denaturing gradient gel electrophoresis. FEMS Immunology and Medical Microbiology. 2007; 51(3):562-8. [DOI:10.1111/j.1574-695X.2007.00337.x] [PMID]
22.Golfetto L, Duarte de Senna F, Hermes J, Beserra BTS, Franca F, Martinello F. Lower bifidobacteria counts in adult patients with celiac disease on a gluten-free diet. Arquivos de Gastroenterologia. 2014; 51(2):139-43. [DOI:10.1590/S0004-28032014000200013] [PMID]
23.Moraes LF, Grzeskowiak LM, Teixeira TF, Gouveia Peluzio M. Intestinal microbiota and probiotics in celiac disease. Clinical Microbiology Reviews. 2014; 27(3):482-9. [DOI:10.1128/CMR.00106-13] [PMID] [PMCID]
24.Nistal E, Caminero A, Vivas S, Ruiz de Morales JM, Saenz de Miera LE, Rodriguez-Aparicio LB, et al. Differences in faecal bacteria populations and faecal bacteria metabolism in healthy adults and celiac disease patients. Biochimie. 2012; 94(8):1724-9. [DOI:10.1016/j.biochi.2012.03.025] [PMID]
25.Abdullah GA, Jamalludeen NM, Mansour AA. The role of probiotics in celiac disease and their potential effect on immunological and clinical markers of the disease. International Journal of Scientific & Engineering Research. 2017; 8(9):1347-73. [Link]
26.Di Biase AR, Marasco G, Ravaioli F, Dajti E, Colecchia L, Righi B, et al. Gut microbiota signatures and clinical manifestations in celiac disease children at onset: A pilot study. Journal of Gastroenterology and Hepatology. 2021; 36(2):446-54. [DOI:10.1111/jgh.15183] [PMID]
27.Sanchez E, Ribes-Koninckx C, Calabuig M, Sanz Y. Intestinal Staphylococcus spp. and virulent features associated with coeliac disease. Journal of Clinical Pathology. 2012; 65(9):830-4. [DOI:10.1136/jclinpath-2012-200759] [PMID]
28.Collado MC, Donat E, Ribes-Koninckx C, Calabuig M, Sanz Y. Imbalances in faecal and duodenal Bifidobacterium species composition in active and non-active coeliac disease. BMC Microbiology. 2008; 8:232. [DOI:10.1186/1471-2180-8-232] [PMID] [PMCID]
29.De Meij TG, Budding AE, Grasman ME, Kneepkens CM, Savelkoul PH, Mearin ML. Composition and diversity of the duodenal mucosa-associated microbiome in children with untreated coeliac disease. Scandinavian Journal of Gastroenterology. 2013; 48(5):530-6. [DOI:10.3109/00365521.2013.775666] [PMID]
30.Schippa S, Iebba V, Barbato M, Di Nardo G, Totino V, Checchi MP, et al. A distinctive ‘microbial signature’ in celiac pediatric patients. BMC Microbiology. 2010; 10:175. [DOI:10.1186/1471-2180-10-175] [PMID] [PMCID]
31.Olivares M, Neef A, Castillejo G, Palma GD, Varea V, Capilla A, et al. The HLA-DQ2 genotype selects for early intestinal microbiota composition in infants at high risk of developing coeliac disease. Gut. 2015; 64(3):406-17. [DOI:10.1136/gutjnl-2014-306931] [PMID]
32.De Palma G, Nadal I, Collado MC, Sanz Y. Effects of a gluten-free diet on gut microbiota and immune function in healthy adult human subjects. The British Journal of Nutrition. 2009; 102(8):1154-60. [DOI:10.1017/S0007114509371767] [PMID]
33.Nylund L, Hakkola S, Lahti L, Salminen S, Kalliomäki M, Yang B, et al. Diet, perceived intestinal well-being and compositions of fecal microbiota and short chain fatty acids in oat-using subjects with celiac disease or gluten sensitivity. Nutrients. 2020; 12(9):2570.[DOI:10.3390/nu12092570] [PMID] [PMCID]
34.Chander AM, Yadav H, Jain S, Bhadada SK, Dhawan DK. Cross-talk between gluten, intestinal microbiota and intestinal mucosa in Celiac disease: Recent advances and basis of autoimmunity. Frontiers in Microbiology. 2018; 9:2597. [DOI:10.3389/fmicb.2018.02597] [PMID] [PMCID]
نوع مطالعه: پژوهشی |
موضوع مقاله:
علوم پايه پزشكي
دریافت: 1400/10/6 | پذیرش: 1401/4/1 | انتشار: 1401/4/10
دریافت: 1400/10/6 | پذیرش: 1401/4/1 | انتشار: 1401/4/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |